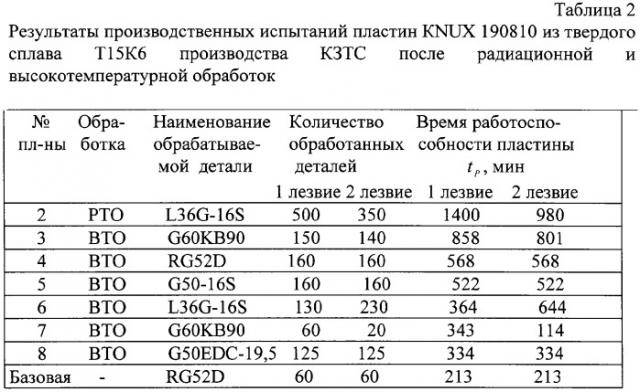
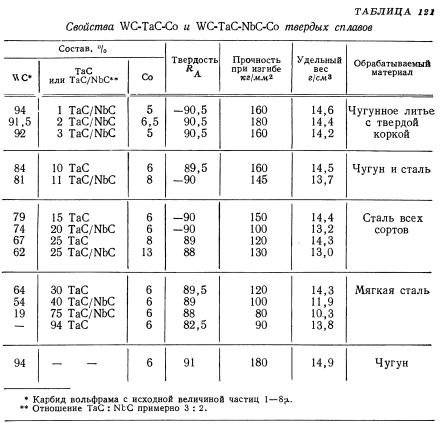
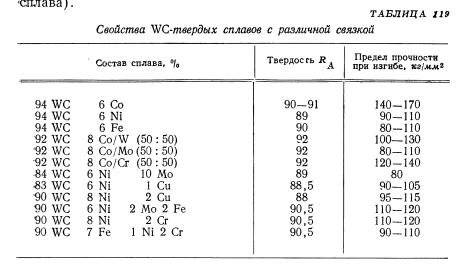
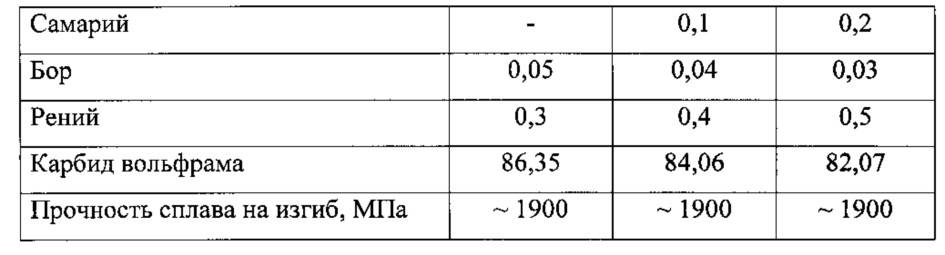
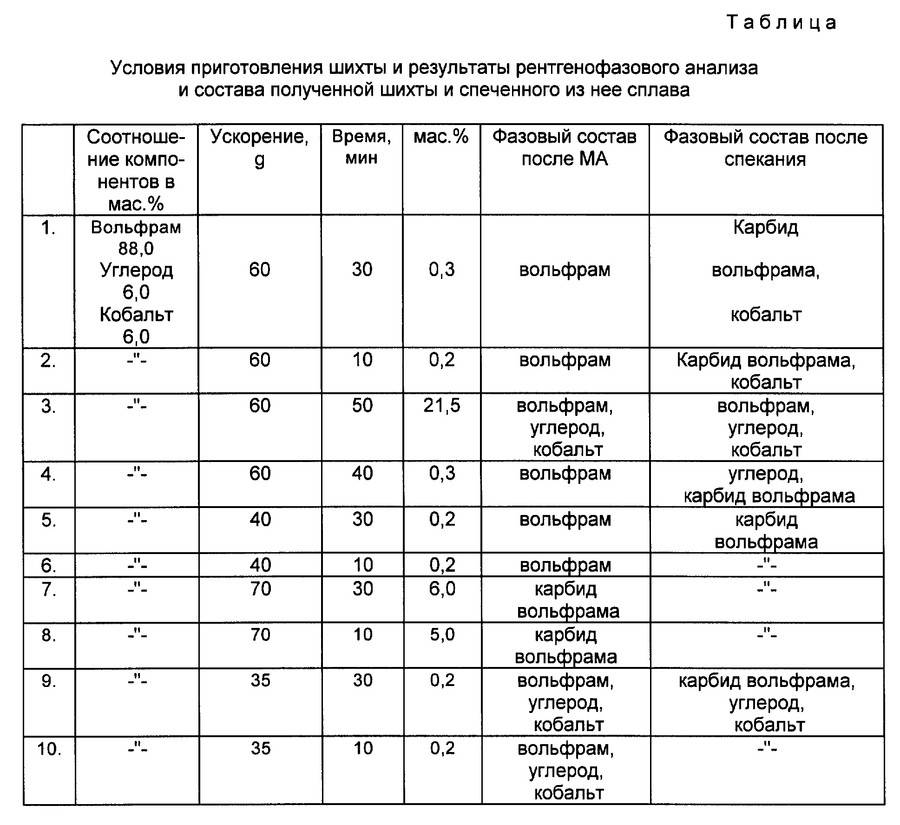
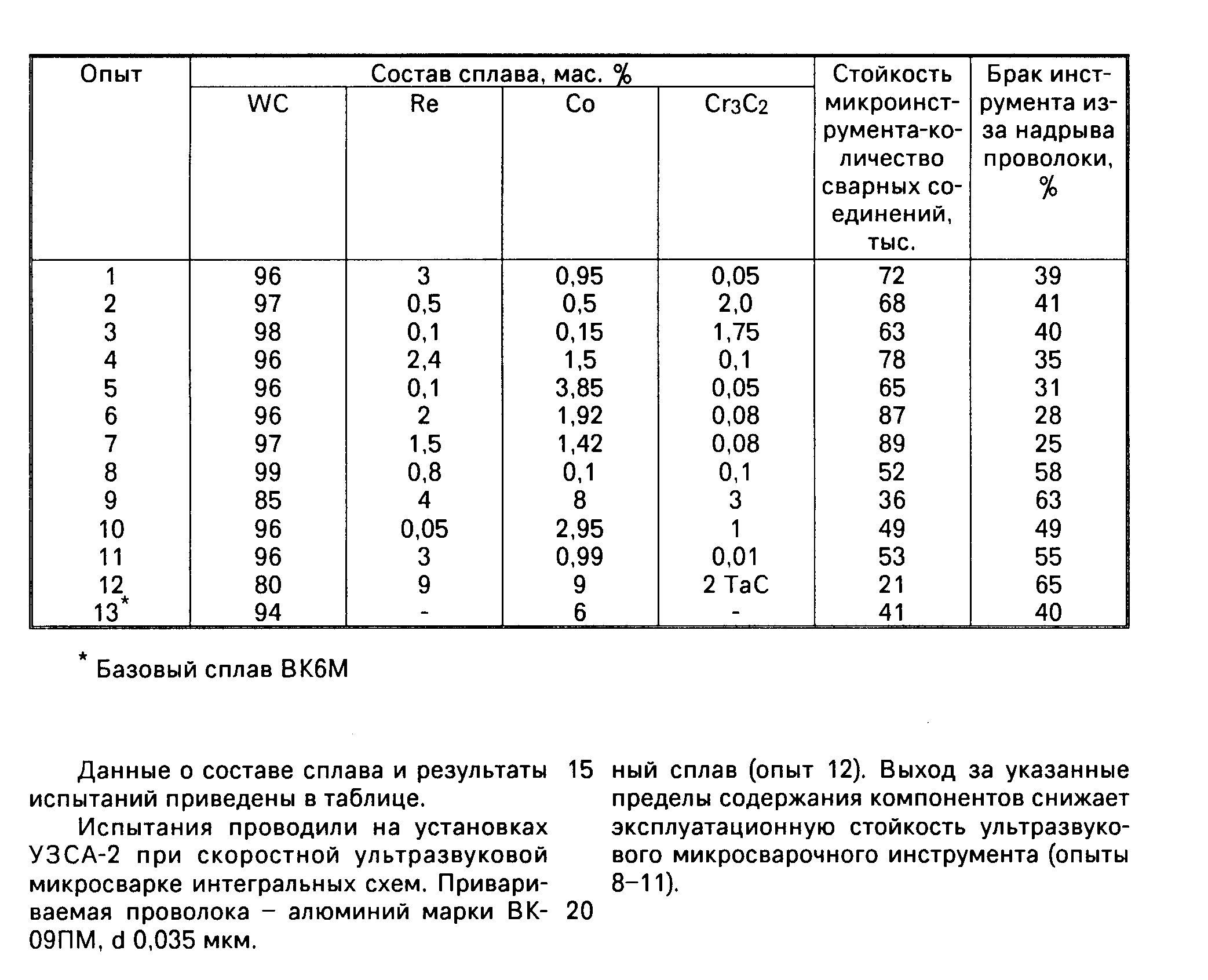
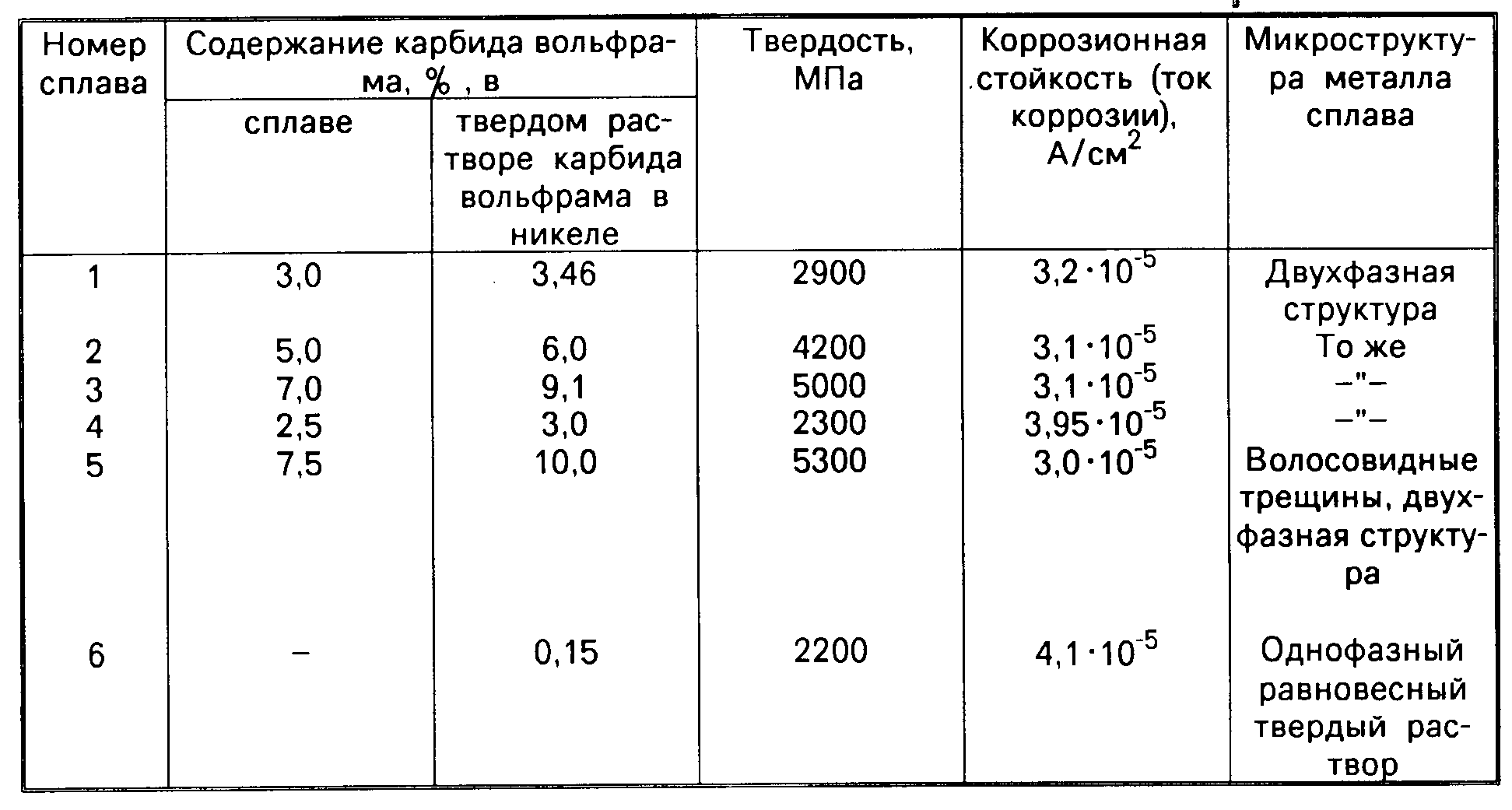
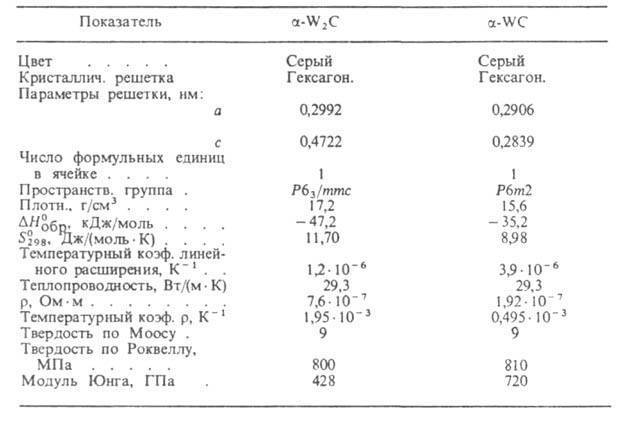
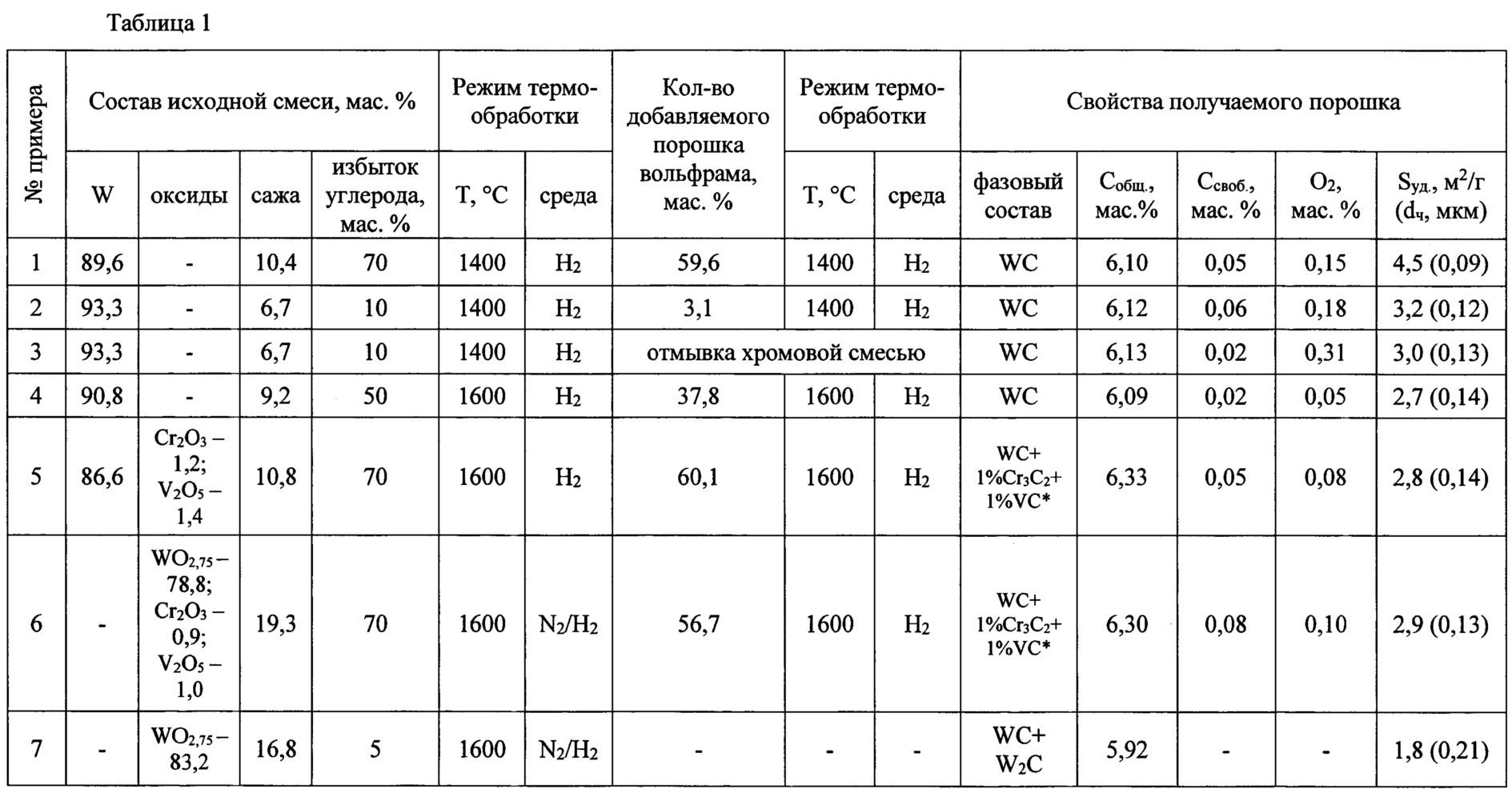
Содержание:
Вольфрам против карбида вольфрама
Вольфрам – это элемент, а карбид вольфрама – неорганическое соединение, образованное им.
Вольфрам
Вольфрам, обозначенный символом W, является элементом переходного металла с атомным номером 74. Это элемент серебристо-белого цвета. Он принадлежит к шестой группе и шестому периоду периодической таблицы. Молекулярная масса вольфрама составляет 183,84 г / моль. Электронная конфигурация вольфрама 4f14 5d4 6 с2. Вольфрам имеет степень окисления от -2 до +6, но наиболее распространенная степень окисления +6. Вольфрам устойчив к реакциям кислорода, кислот и щелочей, когда он находится в больших количествах. Шеелит и вольфрамит – самые важные минералы вольфрама. Вольфрамовые рудники расположены в основном в Китае. Помимо этой шахты, некоторые из них есть в таких странах, как Россия, Австрия, Боливия, Перу и Португалия. Вольфрам более популярен для использования в качестве нити накала ламп. Очень высокая температура плавления (3410 ° C) вольфрама позволила использовать его в лампах. Фактически, у него самая высокая температура плавления из всех элементов. Его температура кипения также очень высока по сравнению с большинством других элементов. Это около 5660 ° C. Вольфрам также используется в электрических контактах и электродах для дуговой сварки.
Карбид вольфрама
Карбид вольфрама – это соединение с формулой WC. Эта формула показывает, что вольфрам и углерод находятся в соединении в равных количествах. Его молярная масса составляет 195,86 г · моль.−1. Карбид вольфрама имеет серо-черный цвет и является твердым веществом. Это соединение имеет температуру плавления 2870 ° C и является одним из самых твердых карбидов. По шкале Мооса он имеет значение твердости около 8,5–9, что является чрезвычайно высоким значением. Один из способов получения карбида вольфрама – это взаимодействие вольфрама с углеродом при очень высокой температуре (1400–2000 ° C). Его также можно синтезировать с помощью запатентованного процесса с псевдоожиженным слоем, методом химического осаждения из паровой фазы и многими другими методами. Существует две формы карбида вольфрама в зависимости от их структурного устройства. Один тип – шестиугольная форма, другой – кубическая форма. Они известны как альфа- и бета-соединения соответственно. В гексагональной структуре с закрытой упаковкой и углерод, и вольфрам имеют координационное число 6. Здесь слои атомов вольфрама лежат непосредственно друг напротив друга, где атомы углерода заполняют половину пустот. Туалет является эффективным проводником электричества и тепла. По проводимости он находится в том же диапазоне, что и инструментальная сталь и углеродистая сталь. Он устойчив к нагреванию и окислению при очень низких температурах. Из-за износостойкости унитаза из него изготавливали фрезы для станков, ножи для сверл, пилы, фрезы, которые используются для металлообработки, деревообработки, горнодобывающей промышленности и строительства. Это также используется при изготовлении украшений. Твердость, долговечность и устойчивость к царапинам сделали его хорошим материалом для изготовления ювелирных изделий. Его также можно использовать в качестве катализатора для усиления химических реакций.
В чем разница между Вольфрам и карбид вольфрама? • Карбид вольфрама – это неорганическое соединение, полученное с использованием чистого элемента, вольфрама. • Вольфрам обозначается как W, а карбид вольфрама обозначается как WC. • Карбид вольфрама тверже вольфрама. • Карбид вольфрама более прочен и устойчив, чем вольфрам. |
Структура
Структура α-WC, атомы углерода серые. Существуют две формы WC: гексагональная форма α-WC ( hP2 , пространственная группа P 6 м2, № 187) и кубическая высокотемпературная форма β-WC, имеющая структуру каменной соли . Гексагональную форму можно представить себе как состоящую из простой гексагональной решетки атомов металлов слоев, лежащих непосредственно друг над другом (т. Е. Не плотно упакованных), с атомами углерода, заполняющими половину пустот, придающих как вольфраму, так и углероду правильную тригонально-призматическую 6 координацию. . Из размеров элементарной ячейки можно определить следующие длины связей: расстояние между атомами вольфрама в гексагонально упакованном слое составляет 291 мкм, кратчайшее расстояние между атомами вольфрама в соседних слоях составляет 284 мкм, а длина углеродной связи вольфрама составляет 220 мкм. . Таким образом, длина связи вольфрам-углерод сравнима с одинарной связью в W ( CH 3 ) 6 (218 пм), в котором сильно искажена тригонально-призматическая координация вольфрама.
Молекулярный WC был исследован, и эта газовая фаза имеет длину связи 171 пм для 184 W 12 C .
Синтез
Карбид вольфрама получают реакцией вольфрам металл и углерод при 1400–2000 ° С. Другие методы включают запатентованный процесс с более низким температурным псевдоожиженным слоем, который реагирует либо на металлический вольфрам, либо на синий WO3 с CO /CO2 смесь и ЧАС2 от 900 до 1200 ° C.
Унитаз также можно производить путем отопления WO3 с графитом: непосредственно при 900 ° C или в водороде при 670 ° C с последующей науглероживанием в аргоне при 1000 ° C.Химическое осаждение из паровой фазы методы, которые были исследованы, включают:
реагируя гексахлорид вольфрама с водородом (как Восстановитель ) и метан (в качестве источника углерода) при 670 ° C (1238 ° F)
- WCl6 + ЧАС2 + CH4 → WC + 6 HCl
реагируя гексафторид вольфрама с водородом (в качестве восстановителя) и метанол (в качестве источника углерода) при 350 ° C (662 ° F)
- WF6 + 2 ЧАС2 + CH3ОЙ → WC + 6 ВЧ + ЧАС2О
Получение[править | править код]
Карбид вольфрама можно получить одним из следующих способов.
- Непосредственным насыщением вольфрама углеродом
В основе процесса получения карбида вольфрама лежит прямая реакция:
- W+C→WC{\displaystyle {\mathsf {W+C\rightarrow WC}}}
Образование WC происходит с образованием на поверхности частиц вольфрама монокарбида вольфрама, из которого внутрь частицы диффундирует углерод и образует ниже лежащий слой состава W2C.
При получении WC используют порошок вольфрама, восстановленный из его оксида, и сажу. Взятые в необходимом соотношении порошкообразные вещества смешивают, брикетируют или насыпают с утрамбовкой в графитовые контейнеры и помещают в печь. Для защиты порошка от окисления процесс синтеза ведут в среде водорода, который взаимодействуя с углеродом при температуре от 1300 °C образует ацетилен. Образование карбида вольфрама идёт в основном через газовую фазу за счёт углерода, содержащегося в газах. Протекают следующие реакции карбидизации:
- 2C+H2→C2H2{\displaystyle {\mathsf {2C+H_{2}\rightarrow C_{2}H_{2}}}}
- 2W+C2H2→2WC+H2{\displaystyle {\mathsf {2W+C_{2}H_{2}\rightarrow 2WC+H_{2}}}}
При наличии в среде оксида углерода процесс идёт по реакции
- C+CO2→2CO{\displaystyle {\mathsf {C+CO_{2}\rightarrow 2CO}}}
- 2CO+W→WC+CO2{\displaystyle {\mathsf {2CO+W\rightarrow WC+CO_{2}}}}
Обычно процесс получения карбида вольфрама ведут при температуре 1300−1350 °C для мелкозернистых порошков вольфрама и 1600 °C для крупнозернистых, а время выдержки составляет от 1 до 2 часов. Полученные слегка спёкшиеся блоки карбида вольфрама измельчают и просеивают через сита.
- Восстановлением оксида вольфрама углеродом с последующей карбидизацией
- Этот метод в отличие от вышеописанного совмещает процесс восстановления и карбидизации вольфрама, при этом в шихту добавляют недостающее количество сажи для образования карбида. Восстановление оксида вольфрама WO3 происходит через газовую фазу в среде CO и водорода.
- Восстановлением соединений вольфрама с последующей карбидизацией
- Ещё одним способом получения карбида вольфрама является нагрев смеси вольфрамовой кислоты, вольфрамового ангидрида (WO3) или паравольфрамата аммония ((NH4)10·[H2W12O42]·xH2O) в среде водорода и метана при температуре 850−1000 °C.
- Осаждением из газовой фазы
- Получение карбида вольфрама из газовой фазы основано на разложении карбонила вольфрама при температуре 1000 °C.
- Электролизом расплавленных солей
- Электролиз смеси расплавленных бората натрия, карбоната натрия, фторида лития и вольфрамового ангидрида позволяет получить карбид вольфрама.
- Монокристаллы карбида вольфрама
- Монокристаллы WC могут быть получены выращиванием из расплава. Для этого смесь составом Co−40 %WC плавят в тигле из оксида алюминия при температуре 1600 °C и после гомогенизации расплава температуру снижают до 1500 °C со скоростью 1−3 °C/мин и выдерживают при этой температуре в течение 12 часов. После чего образец охлаждают и растворяют кобальтовую матрицу в кипящей соляной кислоте. Также может быть использован метод Чохральского для выращивания больших монокристаллов (до 1 см).
Карбиды ниобия Nb2C и NbC
В таблице даны физические свойства карбидов ниобия Nb2C и NbC. Плотный карбид ниобия NbC имеет серовато-коричневый или бледно-лиловый металлический цвет. Порошок NbC имеет фиолетовый оттенок.
Карбиды ниобия при комнатной температуре химически инертны, обладают высокой химической стойкостью к действию кислот и их смесей даже в нагретом состоянии. Однако, они растворимы в смеси плавиковой и азотной кислоты.
При нагревании на воздухе NbC слегка обезуглероживается. До температуры 2500°С он устойчив в атмосфере азота. Температура активного окисления карбида ниобия составляет 900…1000°С. Область температурной устойчивости — до 3890°С. Он стоек в расплавах металлов (Cu, Al), имеет высокую твердость по шкале Мооса.
| Свойства/карбид | Nb2C | NbC |
|---|---|---|
| Молекулярная масса | 197,8 | 105 |
| Тип решетки | Гексагональная | Кубическая |
| Плотность, кг/м3 | 7860 | 7560 |
| Температура плавления, °С | 2927 | 3480 |
| Температура кипения, °С | — | 4500 |
| Твердость по шкале Мооса | — | 9-10 |
| Средний ТКЛР в интервале 20-1100°С, α·106, град-1 | 6,5 | |
| Удельная массовая теплоемкость при 20°С, Дж/(кг·град) | 315 | 355 |
| Молярная теплоемкость при 25°С, кДж/(кмоль·град) | 30,36 | 37,35 |
| Коэффициент теплопроводности при 20°С, Вт/(м·град) | — | 19 |
| Удельное электрическое сопротивление при 20°С, ρ·108, Ом·м | 55 | 46 |
- Чиркин В. С. Теплофизические свойства материалов ядерной техники. М.: Атомиздат, 1967. — 474 с.
- Кржижановский Р. Е., Штерн З. Ю. Теплофизические свойства неметаллических материалов (карбиды). Справочник. Л.: Энергия, 1976. — 120 с.
Физические свойства
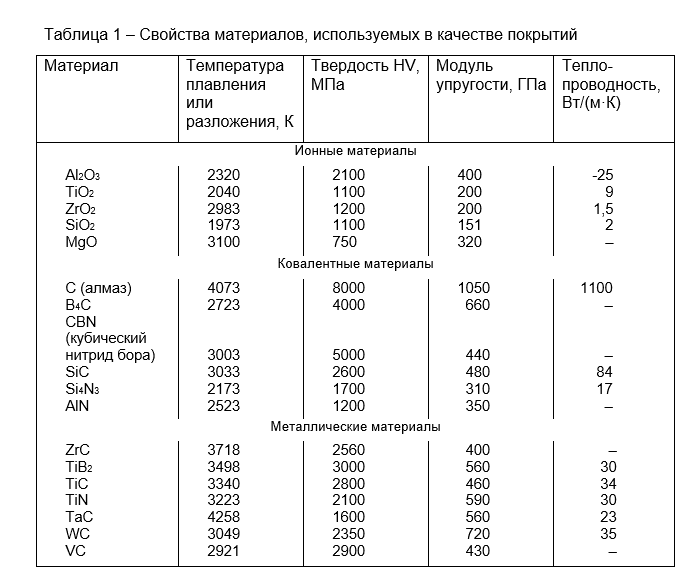
Карбид вольфрама имеет высокую температуру плавления при 2870 ° C (5200 ° F), точку кипения 6000 ° C (10830 ° F) при давлении, эквивалентном 1 стандартной атмосфере (100 кПа), теплопроводность 110 Вт · м -1 · К -1 , и коэффициент теплового расширения 5,5 мкм · м -1 · К -1 .
Карбид вольфрама чрезвычайно трудно, занимая около 9 до 9,5 по шкале Мооса , а также с Виккерсу числом около 2600. Она имеет модуль Юнга приблизительно 530-700 ГПа, модуль объемной упругости от 630-655 ГПа, и модулем сдвига из 274 ГПа. Он имеет предел прочности при растяжении 344 МПа, предел прочности при сжатии около 2,7 ГПа и коэффициент Пуассона 0,31.
Скорость продольной волны ( скорость звука ) через тонкий стержень из карбида вольфрама составляет 6220 м / с.
Низкий карбид вольфрама в электрическом удельном сопротивлении около 0,2 μ Ом · м сравнимы с таковым некоторыми металлами (например , ванадий 0,2 μ Ом · м).
WC легко смачивается как расплавленным никелем, так и кобальтом . Исследование фазовой диаграммы системы WC-Co показывает, что WC и Co образуют псевдобинарную эвтектику . Фазовая диаграмма также показывает , что существуют так называемые n-карбиды с композицией (W, Со)6C, который может образовываться, и хрупкость этих фаз делает важным контроль содержания углерода в карбидах WC-Co. Известно, что в присутствии расплавленной фазы, такой как кобальт, при спекании карбида вольфрама происходит аномальный рост зерен , что оказывает значительное влияние на характеристики материала продукта.
Синтез
Карбид вольфрама получают реакцией вольфрам металл и углерод при 1400–2000 ° С. Другие методы включают запатентованный процесс с более низким температурным псевдоожиженным слоем, который реагирует либо на металлический вольфрам, либо на синий WO3 с CO /CO2 смесь и ЧАС2 от 900 до 1200 ° C.
Унитаз также можно производить путем отопления WO3 с графитом: непосредственно при 900 ° C или в водороде при 670 ° C с последующей науглероживанием в аргоне при 1000 ° C.Химическое осаждение из паровой фазы методы, которые были исследованы, включают:
реагируя гексахлорид вольфрама с водородом (как Восстановитель ) и метан (в качестве источника углерода) при 670 ° C (1238 ° F)
- WCl6 + ЧАС2 + CH4 → WC + 6 HCl
реагируя гексафторид вольфрама с водородом (в качестве восстановителя) и метанол (в качестве источника углерода) при 350 ° C (662 ° F)
- WF6 + 2 ЧАС2 + CH3ОЙ → WC + 6 ВЧ + ЧАС2О
Сплав – карбид – вольфрам
Сплав карбида вольфрама с 16 % кобальта настолько тверд, что может частично заменить алмаз при бурении скважин.
В сплавах карбида вольфрама с молибденом может быть 90 и более процентов твердой фазы. Между частицами карбида вольфрама существуют контакты, хорошо различимые в микроскопе. А в дисперсионно-упрочненных сплавах содержание твердой фазы составляет не более 20 процентов. Твердые частицы упрочняющей фазы изолированы, здесь металлической фазой. Композиция карбида вольфрама с – кобальтом как исключение причислена к классу диспер-сионно-упрочнен ных сплавов. Над загадкой счастливого брака карбида вольфрама и кобальта и технологией получения твердых сплавов на их основе продолжают работать научные коллективы многих стран.
Стеллиты представляют собой сплавы карбидов вольфрама и хрома, связанные кобальтом и железом. Присутствие вольфрама и кобальта удорожает эти сплавы и поэтому они применяются значительно реже сормайта.
Чем больше в сплаве карбида вольфрама, тем сплав тверже, но тем более он хрупок. Вязкость сплава, дающая возможность воспринимать ударные нагрузки, обеспечивается кобальтом. Сплав ВК2, содержащий всего 2 % кобальта, обладает весьма низкой вязкостью.
Чем больше в сплаве карбида вольфрама ( сплавы ВК), тем более он хрупок и менее прочен.
Металлокерамические твердые сплавы представляют собой сплавы карбидов вольфрама и карбидов титана с кобальтом и приготовляются путем прессования и спекания. Эти сплавы применяются для скоростной обработки металлов резанием в виде пластинок, напаиваемых на державку езца. Металлокерамические твердые стали разделяются по ГОСТ 3882 – 53 на две группы.
В табл. 51 приведены некоторые свойства покрытий из сплавов карбида вольфрама.
К первой группе относятся вольфрамовые однокар-бидные сплавы типа ВК ( ВК2, ВКЗМ, ВК4, ВК6, ВК6М, ВК8, ВК8В), представляющие сплав карбида вольфрама с кобальтом, содержание которого колеблется в пределах от 2 до 8 % и выше.
Наиболее подробно изученными являются сплавы монокарбида вольфрама с кубическими карбидами, среди которых особое внимание уделяется сложным карбидам TiC-WC, нашедшим широкое практическое использование в составе металлокерамических твердых сплавов. Показано, что сплавы карбида вольфрама с кубическими карбидами обладают оптимальными свойствами в области твердых растворов
При этом четко проявляется общая тенденция понижения растворимости карбида вольфрама в кубических карбидах при переходе от металлов IV к металлам V группы. Так как в карбиде вольфрама прочность связи Me-С низкая ( из-за незначительной стабилизации 5 / з3 – конфигураций атомов углерода) и WC обладает высоким запасом свободной энергии, то указанный характер изменения растворимости WC в кубических карбидах указывает на различную степень их взаимодействия с карбидом вольфрама, определяемую донорными свойствами металлов карбидов-растворителей.
Еще шире, чем в чистом виде, вольфрам применяется в форме сплавов. Одни из самых важных – металлокврамические сплавы карбида вольфрама и кобальта, которые получили исключительно большое значение, так как Обладают чрезвычайно высокой твердостью.
Вольфрам образует карбиды WC и W2C – вещества, по твердости близкие к алмазу; их применяют в производстве твердых материалов. Большое значение, в частности для буровой техники, имеют сплавы карбида вольфрама с кобальтом, обладающие чрезвычайно большой твердостью. Такой сверхтвердый сплав, называемый победитом, содержит около 90 % карбида вольфрама и около 10 % кобальта.
| Типы ( модели и технические характеристики двухшнековых машин. |
Оба шнековых вала выполнены из нитрированной стали. При желании для переработки абразивных материалов они могут быть полностью или частично покрыты сплавом карбидов вольфрама. Корпус машины охватывает зоны загрузки, смешения и участок дросселирующего элемента. К нему на фланцах присоединен корпус с двумя цилиндрами для разгрузочных шнеков. Корпус этих шнеков изготовлен также из нитрированной стали. Он укреплен на станине машины откидными болтами и при чистке машины может отводиться на роликах.
Металлический – кобальт, серовато-стального цвета, по внешнему виду сходен с железом, но тверже его и никеля. В тонко раздробленном состоянии он легко окисляется во влажном воздухе. При температуре белого каления он сгорает в СозО – i. Из сплавов кобальта назовем стеллит, сталь, содержащую кобальт и хром, отличающуюся весьма большой твердостью и противокоррозийными свойствами; карбалой, сплав карбида вольфрама с кобальтом, также отличается своей очень большой твердостью; магнитную сталь, содержащую 35 % кобальта. Окись кобальта служит для окраски стекла и эмали в синий цвет.
Химические свойства
Есть два хорошо охарактеризованных соединения вольфрама и углерода, WC и полукарбид вольфрама, W2C. Оба соединения могут присутствовать в покрытиях, и пропорции могут зависеть от метода покрытия.
Еще одно метастабильное соединение вольфрама и углерода может быть создано путем нагрева фазы WC до высоких температур с помощью плазмы, а затем закалки в инертном газе (плазменная сфероидизация)..
Этот процесс вызывает сфероидизацию макрокристаллических частиц WC и приводит к нестеициометрической высокотемпературной фазе. Туалет1-х существует в метастабильной форме при комнатной температуре. Тонкая микроструктура этой фазы обеспечивает высокую твердость (2800-3500 HV) в сочетании с хорошей ударной вязкостью по сравнению с другими соединениями карбида вольфрама. Мета-стабильная природа этого соединения приводит к снижению высокотемпературной стабильности.
При высоких температурах WC разлагается на вольфрам и углерод, что может происходить при высоких температурах. термальный спрей, например, в методах высокоскоростного кислородного топлива (HVOF) и высокоэнергетической плазмы (HEP).
Окисление WC начинается при 500–600 ° C (932–1112 ° F). Устойчив к кислоты и атакован только плавиковая кислота /азотная кислота (ВЧ /HNO3) смеси выше комнатной температуры. Он реагирует с фтор газ при комнатной температуре и хлор выше 400 ° C (752 ° F) и не реагирует на высыхание ЧАС2 до температуры плавления. Мелкодисперсный WC легко окисляется в пероксид водорода водные растворы. При высоких температурах и давлениях реагирует с водным карбонат натрия формирование вольфрамат натрия, процедура, используемая для восстановления лома цементированного карбида из-за его селективности.
Применение
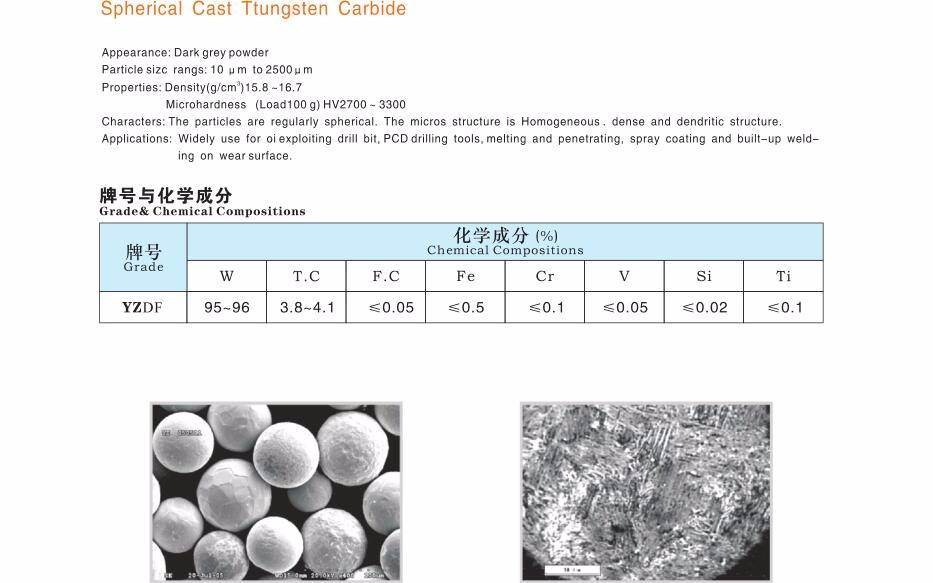
Карбид вольфрама активно применяется в технике для изготовления инструментов, требующих высокой твёрдости и коррозионной стойкости, а также для износостойкой наплавки деталей, работающих в условиях интенсивного абразивного изнашивания с умеренными ударными нагрузками. Этот материал находит применение в изготовлении различных резцов, абразивных дисков, свёрл, фрез, долот для бурения и другого режущего инструмента. Твёрдый сплав, известный как «победит», «рэлит», на 90 % состоит из карбида вольфрама.
Активно применяется в газотермическом напылении и наплавке в виде порошкового материала для создания износостойких покрытий. Один из основных материалов, использующихся для замены гальванического хромирования методом высокоскоростного газопламенного напыления.
Особо следует выделить использование карбида вольфрама для изготовления сердечников бронебойных пуль и снарядов. Сейчас этот материал является доминирующим в данном применении, однако в последнее время в ряде стран он вытесняется обеднённым ураном.
Применяется при производстве сверхпрочных шариков для шариковых ручек размером 1 мм. Полировка этих шариков проводится в специальной машине на протяжении нескольких дней с использованием малого количества алмазной пасты.
Применяется для изготовления браслетов для дорогих швейцарских часов. Также карбид вольфрама приобрёл большую популярность при изготовлении ювелирных изделий — колец, кулонов — в которых его износостойкость позволяет гарантировать «вечный» блеск изделий.
Карбид вольфрама используется в виде подложки для платинового катализатора .
Также используется при изготовлении торцевых уплотнений валов механизмов (например в насосах) в случаях, когда контактирующая среда имеет высокую абразивность и/или вязкость.
Физические свойства
Карбид вольфрама имеет высокую температуру плавления при 2870 ° C (5200 ° F), точку кипения 6000 ° C (10830 ° F) при давлении, эквивалентном 1 стандартной атмосфере (100 кПа), теплопроводность 110 Вт · м -1 · K -1 , и коэффициент теплового расширения 5,5 мкм
· м -1 · K -1 .
Карбид вольфрама чрезвычайно трудно, занимая около 9 до 9,5 по шкале Мооса , а также с Виккерсу числом около 2600. Она имеет модуль Юнга приблизительно 530-700 ГПа, модуль объемной упругости от 630-655 ГПа, и модулем сдвига из 274 ГПа. Он имеет предел прочности при растяжении 344 МПа, предел прочности при сжатии около 2,7 ГПа и коэффициент Пуассона 0,31.
Скорость продольной волны ( скорость звука ) через тонкий стержень из карбида вольфрама составляет 6220 м / с.
Низкий карбид вольфрама в электрическом удельном сопротивлении около 0,2 μ
Ом · м сравнимы с таковым некоторыми металлами (например , ванадий 0,2μ Ом · м).
WC легко смачивается как расплавленным никелем, так и кобальтом . Исследование фазовой диаграммы системы WC-Co показывает, что WC и Co образуют псевдобинарную эвтектику . На фазовой диаграмме также видно, что существуют так называемые η-карбиды состава (W, Co) 6 C, который может образовываться, и хрупкость этих фаз делают важным контроль содержания углерода в карбидах WC-Co.
Карбиды хрома
Таблица содержит физические свойства карбидов хрома различного состава. Соединения с формулой Cr23C6 и Cr3C2 имеют серый цвет; Cr7C3 — серебристый.
Карбиды хрома Cr23C6 и Cr7C3 нерастворимы в царской водке. После длительного нагрева при 730…870°С карбид Cr7C3 превращается в Cr23C6. Карбид Cr3C2 нерастворим в воде. Изделия из него также практически нерастворимы в кислотах, их смесях и растворах щелочей. Однако, он может взаимодействовать с цинком при температуре 940°С. Температура начала окисления Cr3C2 составляет 900…1000°С. Физические свойства карбидов хрома Cr4C, Cr23C6, Cr7C3, Cr3C2
| Свойства/карбид | Cr4C | Cr23C6 | Cr7C3 | Cr3C2 |
| Молекулярная масса | 220 | 1265 | 400 | 180 |
| Тип решетки | Кубическая | Кубическая | Гексагональная | Ромбическая |
| Плотность, кг/м3 | — | 6970 | 6920 | 6680 |
| Температура плавления, °С | 1520 | 1550 | 1700±50 | 1890 (разлаг.) |
| Средний ТКЛР в интервале 20-800°С, α·106, град-1 | — | 10,1 | 10 | 10,3 |
| Удельная массовая теплоемкость при 20°С, Дж/(кг·град) | — | 493 | 523 | 546 |
| Молярная теплоемкость при 20°С, кДж/(кмоль·град) | — | 84 | 209 | 98 |
| Коэффициент теплопроводности при 20°С, Вт/(м·град) | — | 18,7 | 16,6 | 16,2 |
Свойства
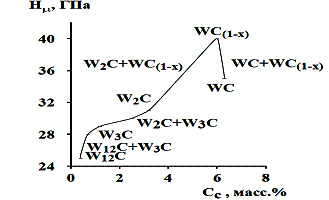
Рассматриваемое вещество представлено серым порошком в двух кристаллографических вариантах: с кубической (полукарбид) и гексагональной (монокарбид) решетками. Обе модификации встречаются в температурном диапазоне 2525 — 2755°С. Вторая фаза ввиду отсутствия области гомогенности при отклонении от стехиометрического состава образует графит или переходит в W2C, а при температуре более 2755°С разлагается до углерода и первой фазы. Последняя отличается обширной областью гомогенности, сокращающейся при снижении температуры.
Монокарбид вольфрама менее тверд в сравнении с полукарбидом, но способен формировать кристаллы. Второй вариант значительно более температуро- и износоустойчив. К тому же он способен к внедрению в твердые растворы.
Карбид вольфрама отличается хрупкостью, но под влиянием нагрузки проявляет пластичность полосами скольжения.
Кристаллы рассматриваемого вещества характеризуются анизотропией твердости от 13 до 22 ГПа на разных кристаллографических плоскостях.
Монокарбид имеет температуру плавления 2870°C, кипения — 6000°C. Его молярная теплоемкость равна 35,74 Дж/(моль-*К), теплопроводность — 29,33 кДж/моль. Плотность карбида вольфрама данного типа составляет 15,77 г/см3.
Несмотря на то, что температура плавления большая, термостойкость рассматриваемого материала низка. Это обусловлено отсутствием термического расширения ввиду жесткой структуры. При этом карбид вольфрама характеризуется высокой теплопроводностью. С повышением температуры данный параметр у монокарбида возрастает вдвое быстрее, чем у полукарбида.

Кольцо из карбида вольфрама
Рассматриваемые материалы имеют хорошую электропроводность, особенно полукарбид (в 4 раза выше, чем монокарбид). Удельное электросопротивление возрастает с повышением температуры, но при этом снижается упругость. Это обуславливает обрабатываемость электрофизическими методами. Так, при введении источника тепла в области обработки возрастает температура, способствуя размеренному разрушению структуры материала.
Твердость определяется температурой формирования карбидов в вольфрамовом порошке и (в меньшей степени) их пористостью. С ростом температуры увеличивается подвижность атомов составляющих соединения элементов, вследствие чего устраняются дефекты в зернах. Анизотропия параметров карбидов вольфрама меньше, чем для металлов. К тому же данные материалы отличаются наилучшей для тугоплавких металлов упругостью, которая увеличивается с ростом пористости. Однако пластичность низкая (до 0,015%).

Микроструктура карбида вольфрама
Карбид вольфрама характеризуется стойкостью к многим кислотам, а также их смесям при обычной температуре, но растворим в некоторых кислотах при кипении. Не подвержен растворению в 20% и 10% гидроксиде натрия. Ввиду высокой летучести оксида вольфрама начинает окисляться при 500 — 700°C и завершает окисление при более 800°C.
Наконец, ввиду химической инертности данное соединение нетоксично.
Нанесение защитного слоя на деталь
Вследствие описанных выше факторов, при покрытии карбидами вольфрама поверхности деталей возрастают не только их износостойкость, но также стойкость против эрозии и окалины. Фактор хрупкости снимается за счёт чрезвычайно малой толщины наносимого карбидсодержащего слоя, который в большинстве случаев не превышает десятков микрон. Такой способ применения карбидов вольфрама более целесообразен: наличие пластичной подложки основного металла снижает чувствительность поверхности от вредного воздействия циклически возникающих рабочих нагрузок, в то время, как высокая поверхностная твёрдость способствует стойкости против износа. Сокращается и расход металлов/сплавов.
Практический диапазон толщины покрытий, содержащих карбиды вольфрама – 100…250 мкм.
Применяются следующиеметоды нанесения поверхностных покрытий из карбида вольфрама:
- Газопламенное напыление.
- Плазменное напыление.
- Детонационное нанесение.
При газопламенном напылении мелкодисперсный порошок карбида расплавляется теплом кислородно-ацетиленового пламени, температура в факеле которого достигает 20000С. Скорость движения частиц в газовом потоке достигает 150…200 м/с, вследствие чего они приобретают большую кинетическую энергию. Она позволяет частицам легко внедряться в микропустоты на поверхности основного металла, а застывая там, образовывать прочное покрытие.
Технология газопламенного напыления обладает существенным недостатком. Наличие кислорода в пламени способствует частичному выгоранию углерода. Поэтому более качественными процессами напыления, являются технологии с применением плазмы. Высокотемпературная (более 50000С) плазма исключает попадания в зону обработки даже атомарного кислорода, поэтому химсостав конечного карбидсодержащего слоя полностью соответствует исходному. Кроме того, производительность плазменного напыления выше, чем газопламенного, т.к. в последнем случае рабочую камеру периодически приходится очищать от остатков выделившегося углерода методом аргонной откачки.
При детонационном напылении деталь помещают в подвижную среду, где находятся взвешенные частицы карбидов вольфрама. Объём герметизируется, после чего среда поджигается. Возникающие в результате высокие температуры резко увеличивают скорость перемещения взвешенных частиц, которые равномерным слоем откладываются на поверхности детали.
Физические свойства
Карбид вольфрама представляет собой порошок серого цвета. Имеет две кристаллографические модификации: α-WC с гексагональной решёткой (периоды решетки a = 0,2906 нм, c = 0,2839 нм), пространственная группа P6m2 и β-WC с кубической гранецентрированной решеткой (a = 0,4220 нм), пространственная группа Fm3m, которая устойчива свыше 2525 °C. При этом в интервале температур 2525−2755 °C существуют обе фазы. Фаза α-WC не имеет области гомогенности, поэтому отклонение от стехиометрического состава приводит к появлению W2C или графита. При нагреве выше 2755 °C α-WC разлагается, образуя углерод и фазу β-WC. Фаза β-WC описывается формулой β-WC1−x, где (0 ⩽ x ⩽ 0,41) и имеет широкую область гомогенности, которая с понижением температуры уменьшается.
Обычно карбид вольфрама считается хрупким соединением, однако обнаружено, что под нагрузкой он проявляет пластические свойства, которые проявляются в виде полос скольжения.
Кристаллы карбида вольфрама имеют анизотропию твёрдости в различных кристаллографических плоскостях. В зависимости от ориентации минимальное значение микротвёрдости составляет 13 ГПа, а максимальное — 22 ГПа.
- Твёрдость по Роквеллу 92−94 HRA
- Модуль упругости 710 ГПа
- Стандартная энтропия 8,5 ± 1,5 кал/(моль·°C)
- Энтропия образования из элементов −0,31 кал/(моль·°C)
- Коэффициент линейного теплового расширения 3,84−3,9·10−6 1/K
- Характеристическая температура (температура Дебая) 493 K
- Удельное электрическое сопротивление 19,2 ± 0,3 мкОм·см при 20 °C
- Удельная электропроводность 52200 Ом−1·см−1
- Термический коэффициент электросопротивления +0,495·10−3 1/K при 20−1500 °C
- Коэффициент термо-ЭДС −23,3 мкВ/K
- Работа выхода 3,6 эВ
- Постоянная Ричардсона 2,7 А/(см2·K2)
- Постоянная Холла (−21,8 ± 0,3)·104 см3/Kл
- Коэффициент электронной теплоёмкости 0,79 мДж/(моль·K2)
Свойства
Рассматриваемое вещество представлено серым порошком в двух кристаллографических вариантах: с кубической (полукарбид) и гексагональной (монокарбид) решетками. Обе модификации встречаются в температурном диапазоне 2525 — 2755°С. Вторая фаза ввиду отсутствия области гомогенности при отклонении от стехиометрического состава образует графит или переходит в W2C, а при температуре более 2755°С разлагается до углерода и первой фазы. Последняя отличается обширной областью гомогенности, сокращающейся при снижении температуры.
Монокарбид вольфрама менее тверд в сравнении с полукарбидом, но способен формировать кристаллы. Второй вариант значительно более температуро- и износоустойчив. К тому же он способен к внедрению в твердые растворы.
Карбид вольфрама отличается хрупкостью, но под влиянием нагрузки проявляет пластичность полосами скольжения.
Кристаллы рассматриваемого вещества характеризуются анизотропией твердости от 13 до 22 ГПа на разных кристаллографических плоскостях.
Монокарбид имеет температуру плавления 2870°C, кипения — 6000°C. Его молярная теплоемкость равна 35,74 Дж/(моль-*К), теплопроводность — 29,33 кДж/моль. Плотность карбида вольфрама данного типа составляет 15,77 г/см3.
Несмотря на то, что температура плавления большая, термостойкость рассматриваемого материала низка. Это обусловлено отсутствием термического расширения ввиду жесткой структуры. При этом карбид вольфрама характеризуется высокой теплопроводностью. С повышением температуры данный параметр у монокарбида возрастает вдвое быстрее, чем у полукарбида.

Кольцо из карбида вольфрама
Рассматриваемые материалы имеют хорошую электропроводность, особенно полукарбид (в 4 раза выше, чем монокарбид). Удельное электросопротивление возрастает с повышением температуры, но при этом снижается упругость. Это обуславливает обрабатываемость электрофизическими методами. Так, при введении источника тепла в области обработки возрастает температура, способствуя размеренному разрушению структуры материала.
Твердость определяется температурой формирования карбидов в вольфрамовом порошке и (в меньшей степени) их пористостью. С ростом температуры увеличивается подвижность атомов составляющих соединения элементов, вследствие чего устраняются дефекты в зернах. Анизотропия параметров карбидов вольфрама меньше, чем для металлов. К тому же данные материалы отличаются наилучшей для тугоплавких металлов упругостью, которая увеличивается с ростом пористости. Однако пластичность низкая (до 0,015%).

Микроструктура карбида вольфрама
Карбид вольфрама характеризуется стойкостью к многим кислотам, а также их смесям при обычной температуре, но растворим в некоторых кислотах при кипении. Не подвержен растворению в 20% и 10% гидроксиде натрия. Ввиду высокой летучести оксида вольфрама начинает окисляться при 500 — 700°C и завершает окисление при более 800°C.
Наконец, ввиду химической инертности данное соединение нетоксично.
Карбид вольфрама по сравнению с вольфрамом.
Люди часто используют термины вольфрам и карбид вольфрама взаимозаменяемо. Однако есть различия в свойствах этих двух материалов.
Во-первых, вольфрам легче царапается.
Кольца, изготовленные только из него, не очень устойчивы к царапинам, так что вы не должны ожидать, что они со временем останутся такими же блестящими.
Во-вторых, вольфрамовые ювелирные изделия часто содержит кобальт, в то время как карбид вольфрама, как правило, смешан с никелем. Проблема заключается в том, что, когда кобальт вступает в контакт с кожей, металл может вызвать раздражение.
Кроме того, кобальт может окислиться и заставить ваши драгоценности изменить цвет.