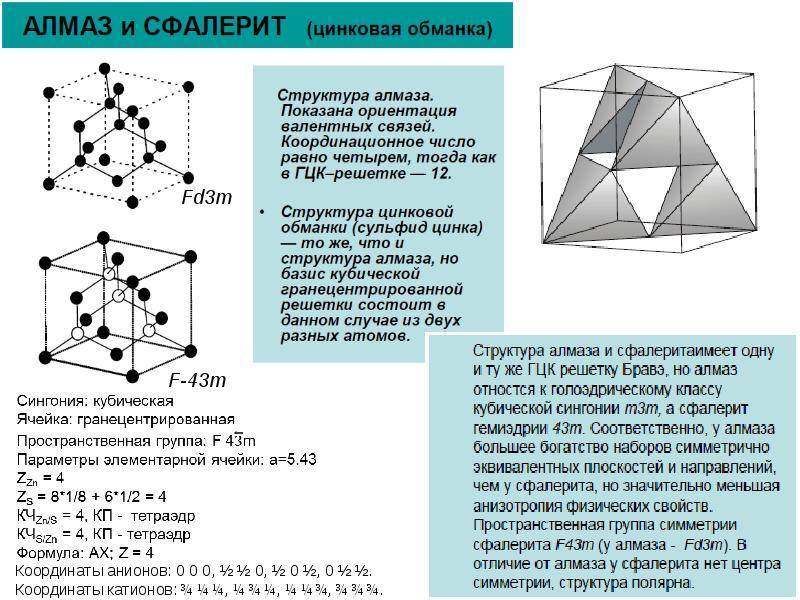
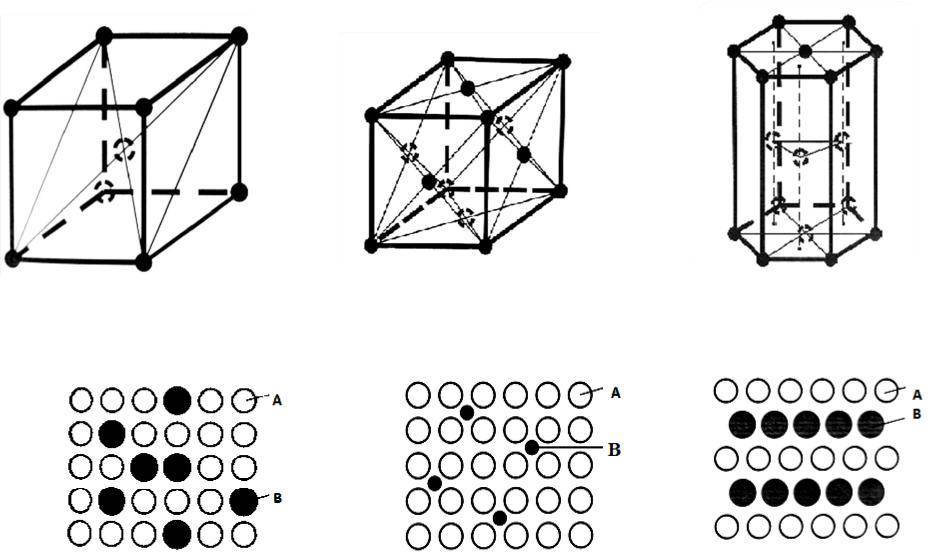
Кристалл классы
В изометрическая кристаллическая система имена классов, точечные группы (в Обозначение Шенфлиса, Обозначения Германа – Могена, орбифолд, и Обозначение Кокстера ), тип, примеры, Международные таблицы кристаллографии номер пространственной группы, и космические группы перечислены в таблице ниже. Всего существует 36 кубических пространственных групп.
| # | Группа точек | Тип | пример | Космические группы | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| имя | Schön. | Intl | Сфера. | Кокс. | Примитивный | По центру лица | По центру тела | |||
| 195–197 | Тетартоидный | 23 | 332 | + | энантиоморфный | Ульманнит, Хлорат натрия | P23 | F23 | I23 | |
| 198–199 | P213 | I213 | ||||||||
| 200–204 | Диплоидный | 2 / м3(м3) | 3*2 | центросимметричный | Пирит | , Pn3 | FM3, Fd3 | я3 | ||
| 205–206 | Па3 | Я3 | ||||||||
| 207–211 | Гироидальный | О | 432 | 432 | + | энантиоморфный | Petzite | P432, P4232 | F432, F4132 | I432 |
| 212–214 | P4332, P4132 | I4132 | ||||||||
| 215–217 | Шестигранный | 43м | *332 | Сфалерит | п43м | я43м | ||||
| 218–220 | п43n | F43c | я43D | |||||||
| 221–230 | Гексоктаэдрический | Очас | 4 / м32 / м(м3м) | *432 | центросимметричный | Галенит, Галит | Вечера3м, Пн3п, , Pn3м | , Fm3c, Fd3м, Fd3c | Я3м, я3d |
Другие термины для гексоктаэдра: нормальный класс, голоэдральный, дитессераль центральный класс, галенит тип.
Наличие порядка в расположении частиц
В аморфном веществе, в отличие от кристаллического, отсутствует какой-либо порядок в расположении частиц. Если же в кристаллическом веществе мысленно соединить прямой два близкоросположенных друг к другу атома, то можно обнаружить, что на этой линии на строго определенных промежутках будут лежать одни и те же частицы:
Таким образом, в случае кристаллических веществах можно говорить о таком понятии, как кристаллическая решетка.
Кристаллической решеткой называют пространственный каркас, соединяющий точки пространства, в которых находятся частицы, образующие кристалл.
Точки пространства, в которых находятся образующие кристалл частицы, называют узлами кристаллической решетки.
В зависимости от того, какие частицы находятся в узлах кристаллической решетки, различают: молекулярную, атомную, ионную и металлическую кристаллические решетки.
В узлах молекулярной кристаллической решетки Кристаллическая решетка льда Кристаллическая решетка льда как пример молекулярной решетки
находятся молекулы, внутри которых атомы связаны прочными ковалентными связями, однако сами молекулы удерживаются друг возле друга слабыми межмолекулярными силами. Вследствие таких слабых межмолекулярных взаимодействий кристаллы с молекулярной решеткой являются непрочными. Такие вещества от веществ с иными типами строения отличаются существенно более низкими температурами плавления и кипения, не проводят электрический ток, могут как растворяться, так и не растворяться в различных растворителях.
Растворы таких соединений могут как проводить, так и не проводить электрический ток в зависимости от класса соединения. К соединениям с молекулярной кристаллической решеткой относятся многие простые вещества — неметаллы (отвержденные H2, O2, Cl2, ромбическая сера S8, белый фосфор P4), а также многие сложные вещества – водородные соединения неметаллов, кислоты, оксиды неметаллов, большинство органических веществ. Следует отметить, что, если вещество находится в газообразном или жидком состоянии, говорить о молекулярной кристаллической решетке неуместно: корректнее использовать термин — молекулярный тип строения.
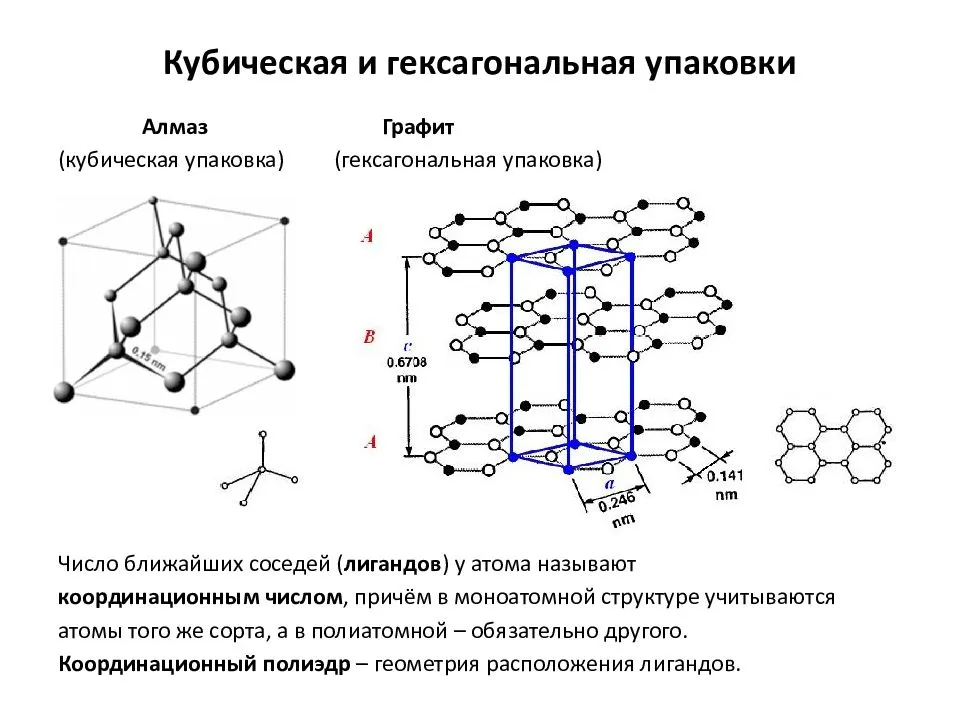
кристаллическая решетка алмаза Кристаллическая решетка алмаза как пример атомной решетки В узлах атомной кристаллической решетки
находятся атомы. При этом все узлы такой кристаллической решетки «сшиты» между собой посредством прочных ковалентных связей в единый кристалл. Фактически, такой кристалл является одной гигантской молекулой. Вследствие особенностей строения все вещества с атомной кристаллической решеткой являются твердыми, обладают высокими температурами плавления, химически мало активны, не растворимы ни в воде, ни в органических растворителях, а их расплавы не проводят электрический ток. Следует запомнить, что к веществам с атомным типом строения из простых веществ относятся бор B, углерод C (алмаз и графит), кремний Si, из сложных веществ — диоксид кремния SiO2 (кварц), карбид кремния SiC, нитрид бора BN.
У веществ с ионной кристаллической решеткой в узлах решетки находятся ионы, связанные друг с другом посредством ионных связей.
Поскольку ионные связи достаточно прочны, вещества с ионной решеткой обладают сравнительно высокой твердостью и тугоплавкостью. Чаще всего они растворимы в воде, а их растворы, как и расплавы проводят электрический ток. К веществам с ионным типом кристаллической решетки относятся соли металлов и аммония (NH4+), основания, оксиды металлов. Верным признаком ионного строения вещества является наличие в его составе одновременно атомов типичного металла и неметалла.
Кристаллическая решетка хлорида натрия
Кристаллическая решетка хлорида натрия как пример ионной решетки Однако следует отметить, что в веществах с ионным типом строения нередко можно обнаружить, помимо ионных, также ковалентные полярные связи. Это наблюдается в случае сложных ионов, т.е. состоящих из двух или более химических элементов (SO42-, NH4+, PO43- и т.д.). Внутри таких сложных ионов атомы связаны друг с другом ковалентными связями.
Металлическая кристаллическая решетка
наблюдается в кристаллах свободных металлов, например, натрия Na, железа Fe, магния Mg и т.д. В случае металлической кристаллической решетки, в ее узлах находятся катионы и атомы металлов, между которыми движутся электроны. При этом движущиеся электроны периодически присоединяются к катионам, таким образом нейтрализуя их заряд, а отдельные нейтральные атомы металлов взамен «отпускают» часть своих электронов, превращаясь, в свою очередь, в катионы. Фактически, «свободные» электроны принадлежат не отдельным атомам, а всему кристаллу.
Ссылки [ править ]
- ^ a b c П. М. де Вольф, Н. В. Белов, Э. Ф. Берто, М. Дж. Бюргер, Д. Д. Донней, В. Фишер, Th. Хан, В.А. Копцик, А.Л. Маккей, Х. Вондрачек, AJC Wilson и SC Abrahams (1985). “Номенклатура семейств кристаллов, типов решетки Браве и арифметических классов. Отчет Специального комитета Международного союза кристаллографии по номенклатуре симметрии” . Acta Crystallographica Раздел A . 41 (3): 278. DOI : 10.1107 / S0108767385000587 .
- ^ Принц, Э., изд. (2006). Международные таблицы для кристаллографии . Международный союз кристаллографии. DOI10.1107 / 97809553602060000001 . ISBN 978-1-4020-4969-9.
- ^ Кристаллография и минералы, упорядоченные по кристаллической форме , Webmineral
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8.
- ^ Первоначальное открытие было в J. Chem. Phys. 14 , 569 (1946).
- ↑ Структура CsCl (B2), заархивированная 15 сентября 2008 г., на Wayback Machine
- ^ a b Зейтц, Современная теория твердого тела (1940), стр.49
- ^ NaCl (B1) Структура архивации 2008-10-19 в Wayback Machine
- ^ Сандквист, JJ; Лин, CC (1981). «Электронная структура F-центра в кристалле фторида натрия». Журнал физики C: Физика твердого тела . 14 (32): 4797–4805. Bibcode1981JPhC … 14.4797S . DOI10.1088 / 0022-3719 / 14/32/016 .
- ^ Абрахамс, Южная Каролина; Бернштейн, JL (1965). «Точность автоматического дифрактометра. Измерение структурных факторов хлорида натрия». Acta Crystallogr. 18 (5): 926–932. DOI10.1107 / S0365110X65002244 .
- ^ Као, Вт .; Перетти, Э. (1970). «Тройная подсистема Sn4As3-SnAs-SnTe». Журнал менее распространенных металлов . 22 : 39–50. DOI10.1016 / 0022-5088 (70) 90174-8 .
- ^ a b c J. Aigueperse, P. Mollard, D. Devilliers, M. Chemla, R. Faron, R. Romano, JP Cuer, «Соединения фтора, неорганические» (раздел 4) в Энциклопедии промышленной химии Ульмана, Wiley- VCH, Weinheim, 2005. doi : 10.1002 / 14356007.a11_307 .
- ^ Гу, Чжэн; Эдгар, JH; Помрой, Дж; Кубалл, М; Коффи, DW (август 2004 г.). «Рост кристаллов и свойства нитрида скандия». Журнал материаловедения: материалы в электронике . 15 (8): 555–559. DOI10,1023 / Б: JMSE.0000032591.54107.2c . S2CID 98462001 .
- ^ «Флюорит» . aflow.org . Проверено 22 мая 2020 .
- ^ “Каменная соль” . aflow.org . Проверено 22 мая 2020 .
- ↑ Л. Канторович (2004). Квантовая теория твердого тела . Springer. п. 32. ISBN 1-4020-2153-4.
- ^ Биркбек-колледж, Лондонский университет
- ^ Цинковой обманки (B3) Структура архивации 19 октября 2008, в Wayback Machine
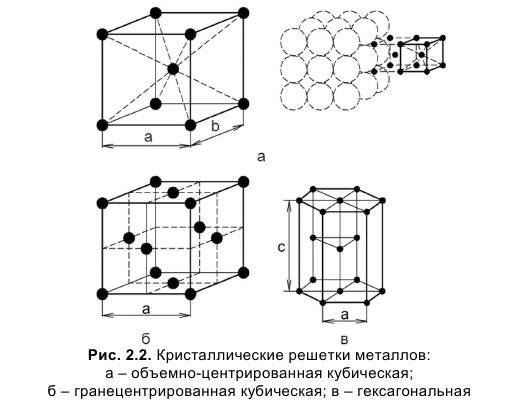
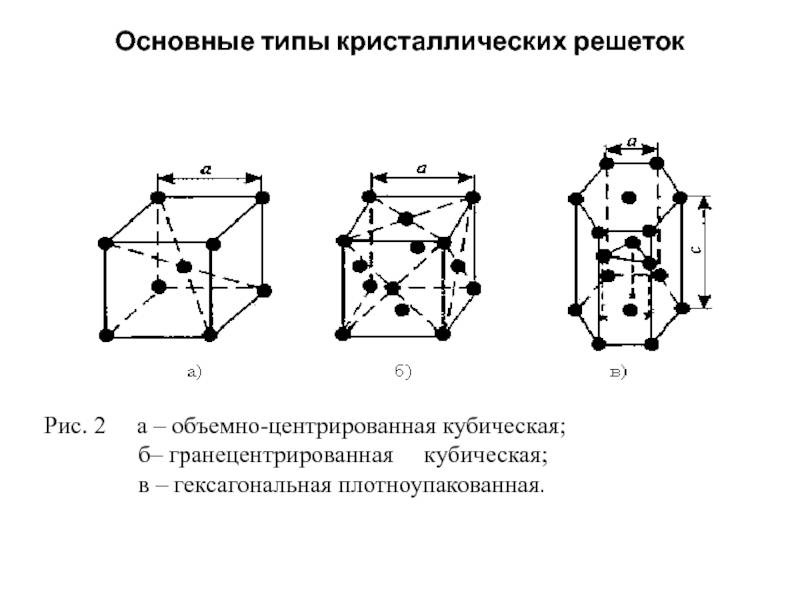
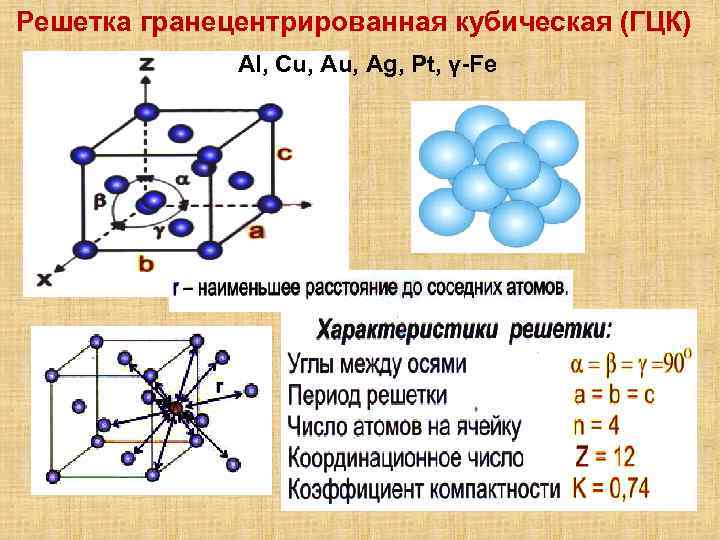
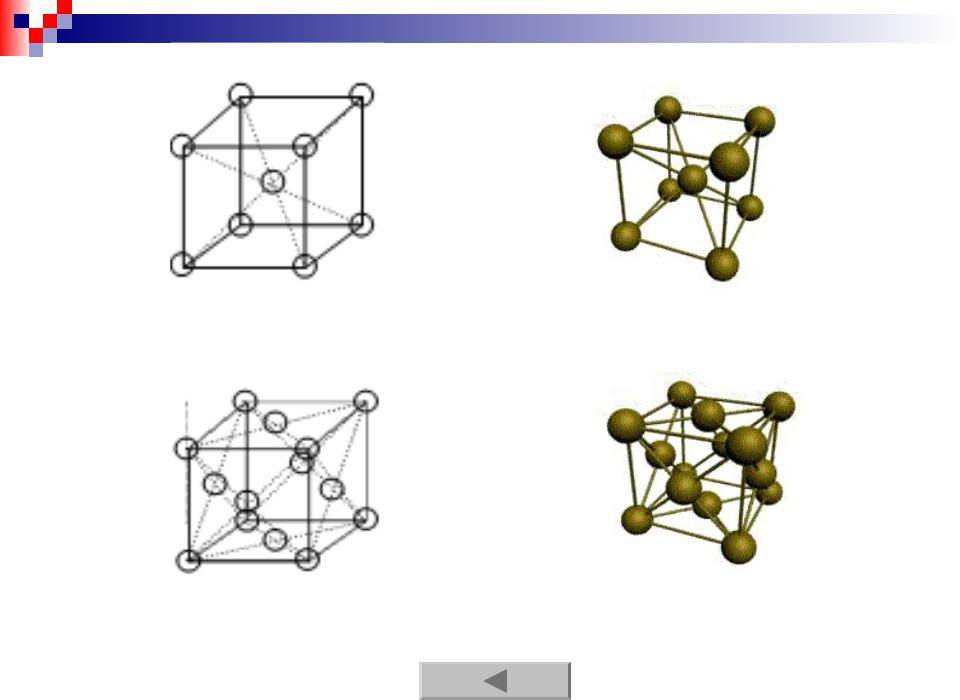
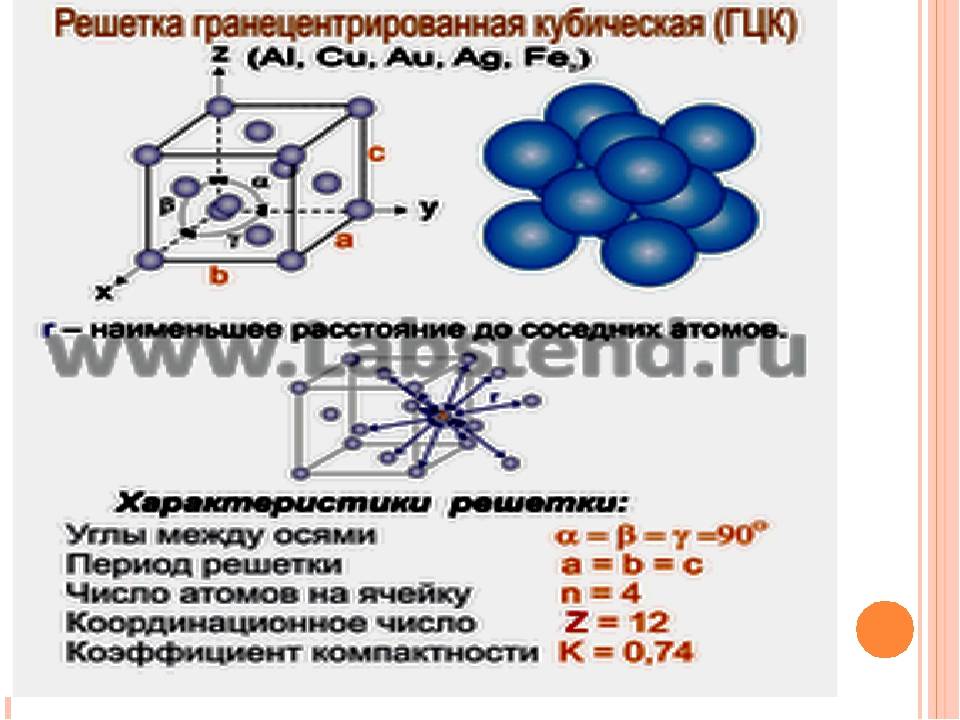
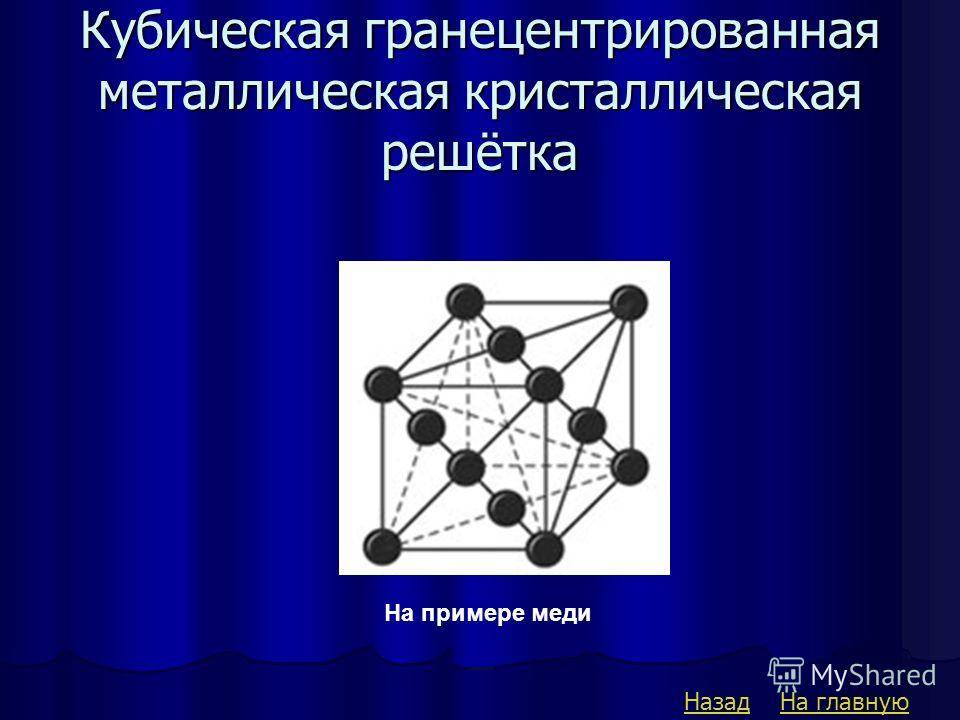
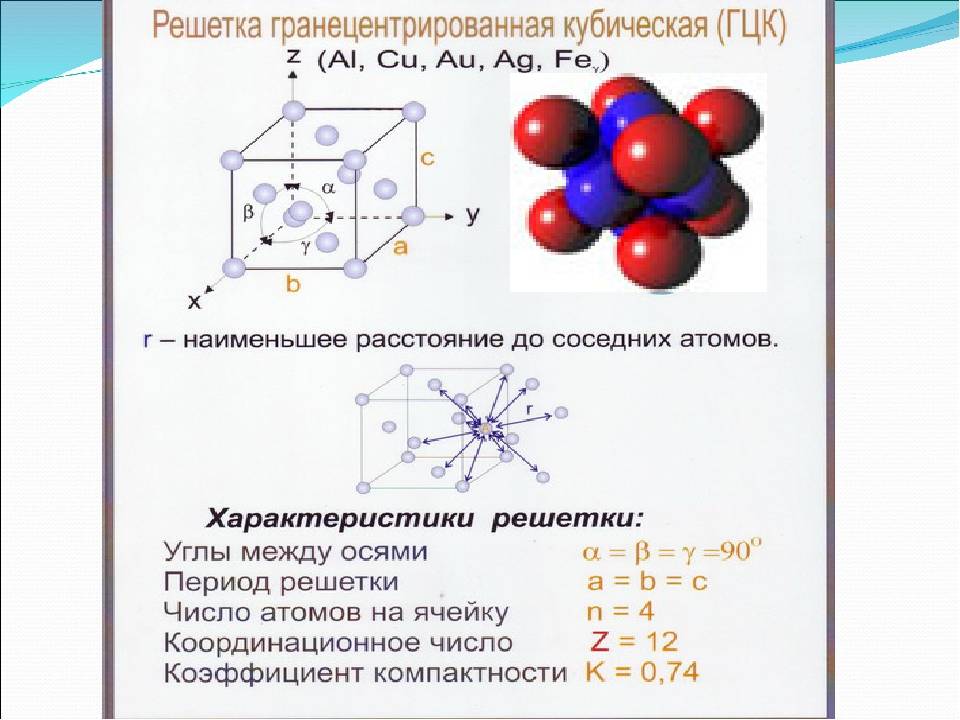
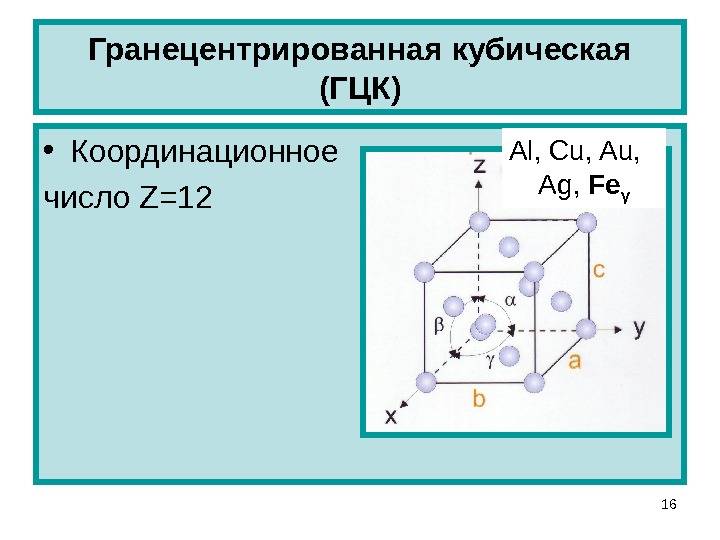
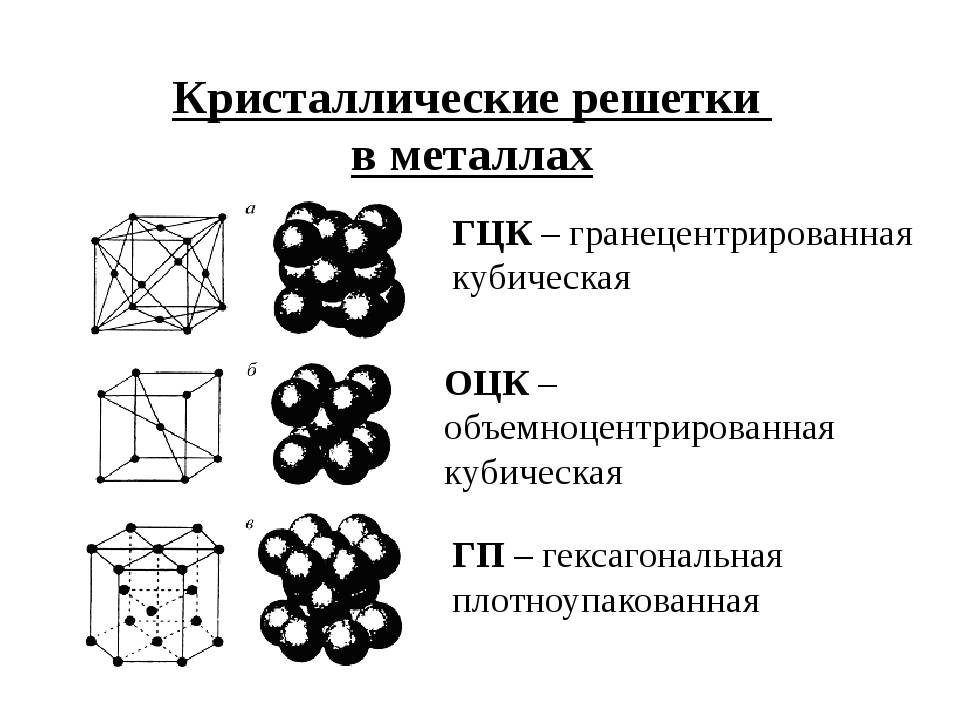
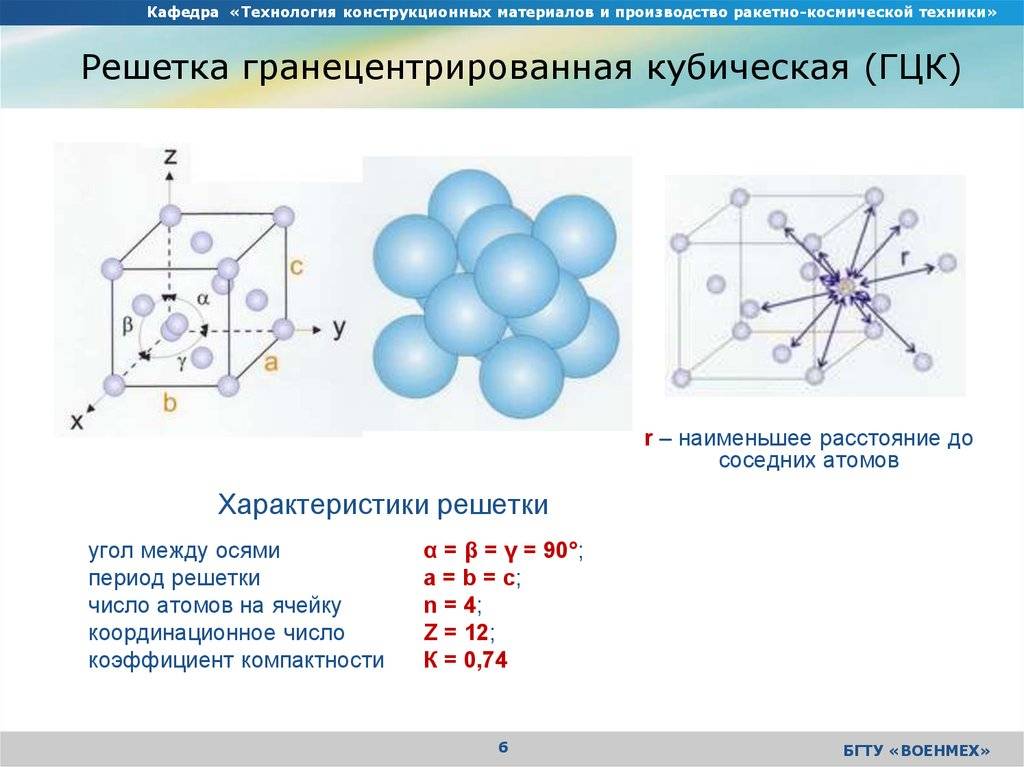
Кубическая гранецентрированная решетка
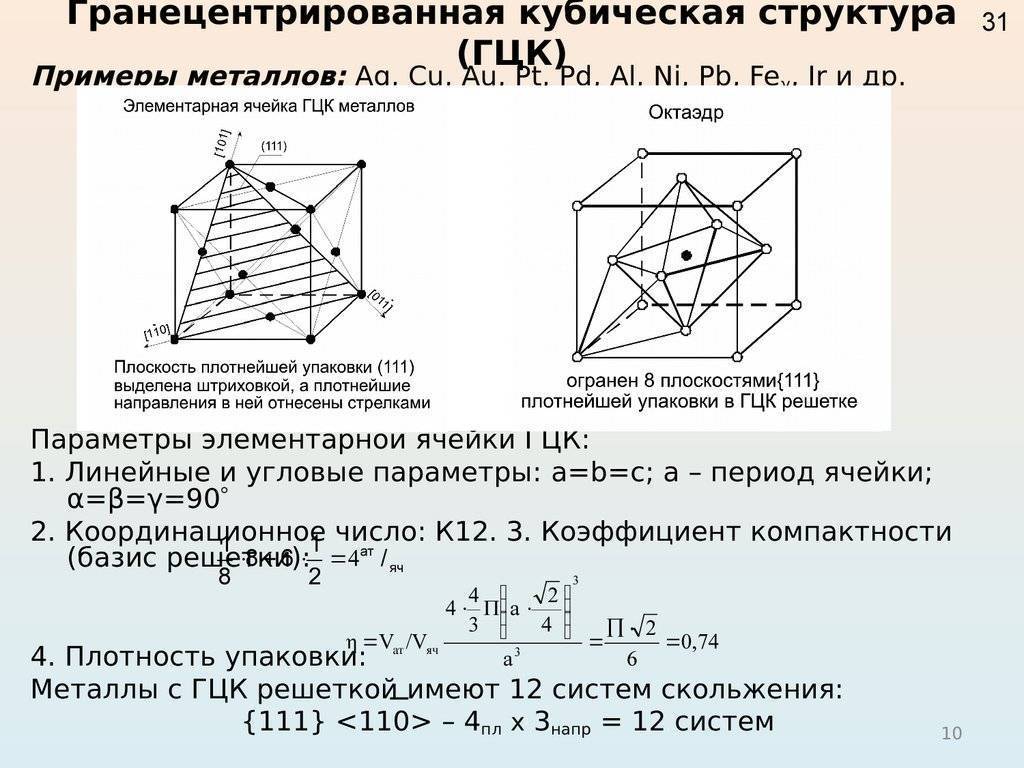
Кубическая гранецентрированная решетка является основой металлов: алюминия, железа ( у-железа), кобальта, родия, палладия, платины, меди, серебра, золота, свинца и некоторых других металлов и редкоземельных элементов. Гексагональная плотноупакованная решетка является основой металлов: бериллия, магния, кадмия, таллия.
| Кристаллическая решетка.| Структура льда. |
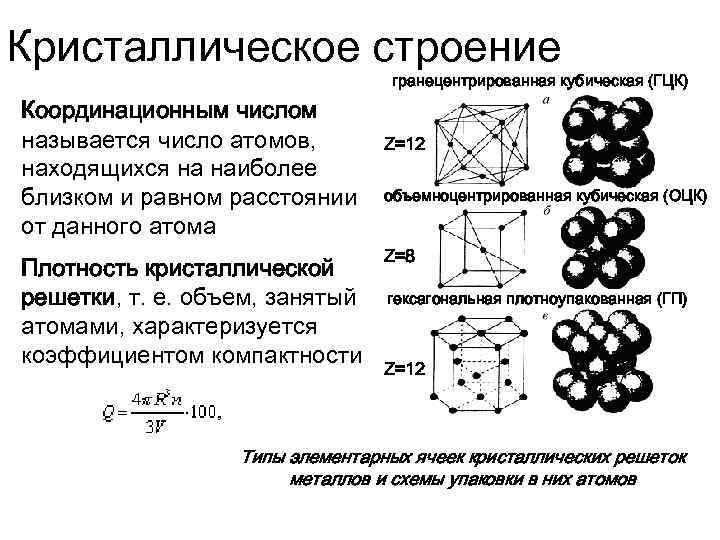
Кубическую гранецентрированную решетку имеет, например, медь, кубическую объемноцентрированную – железо, гексагональную – магний.
| Основные виды элементарных ячеек кристаллических решеток металлов. |
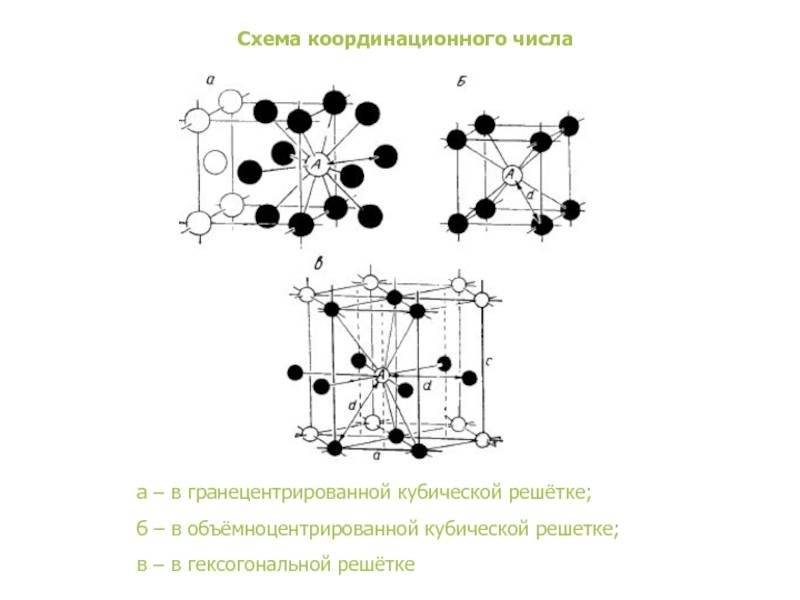
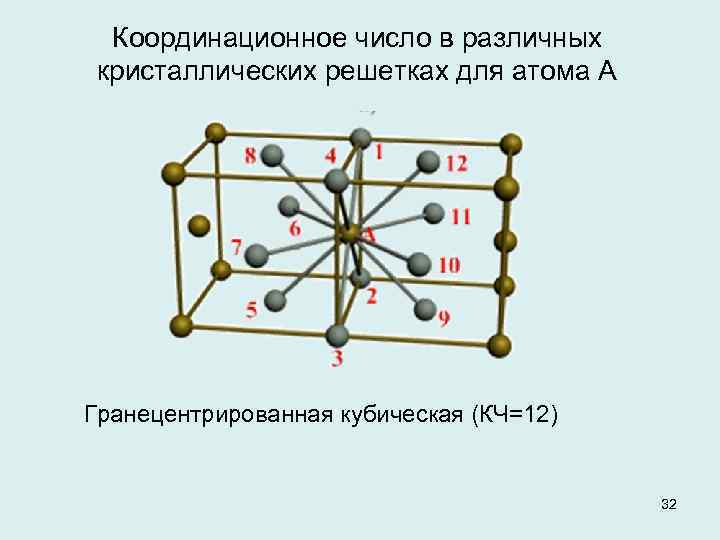
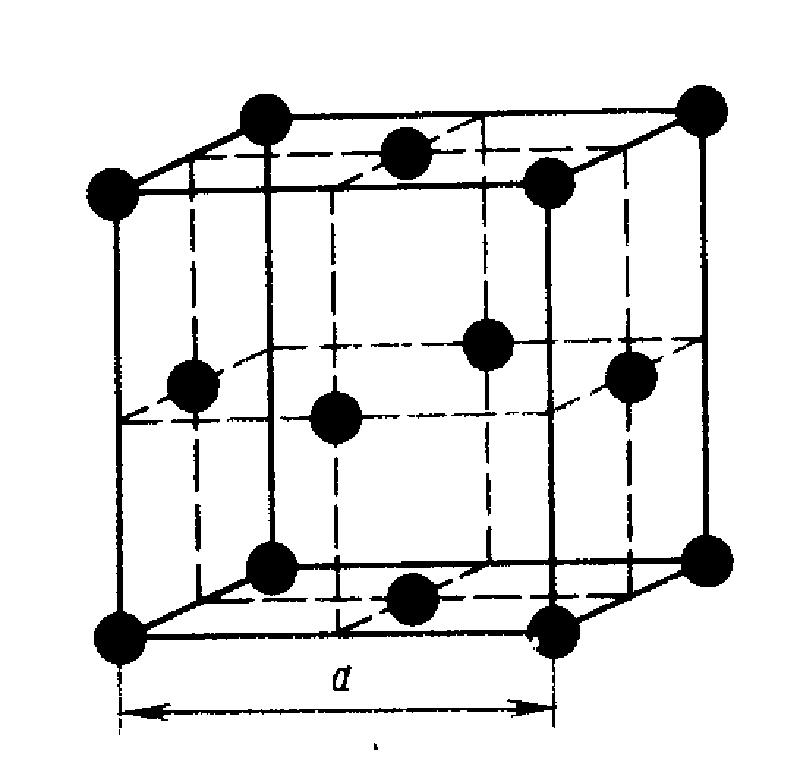
В кубической гранецентрированной решетке К12 ( рис. 18, в и 19, б) число атомов равно четырем: 1 / 8 – 8 1 атом от числа атомов, расположенных в вершинах куба и плюс V2 – 6 3 атома от числа атомов, расположенных в центре граней куба. Кубическую гранецентриро-ванную решетку имеют Fev, Ni, Al, Cop и другие металлы.
| Основные виды элементарных ячеек кристаллических решеток металлов. |
В кубической гранецентрированной решетке К12 ( рис. 18, в и 19, б) число атомов равно четырем: 1 / 8 – 8 1 атом от числа атомов, расположенных в вершинах куба и плюс 1 / 2 – 6 3 атома от числа атомов, расположенных в центре граней куба. Кубическую гранецентриро-ванную решетку имеют Fev, Ni, Al, Cop и другие металлы.
В кубической гранецентрированной решетке ( рис. 2) в восьми углах и шести центрах граней куба находятся атомы одного и того же металла, связанные между собой металлическими связями.
В кубической гранецентрированной решетке базисные векторы прямой решетки выбираются в виде ai 2 – 2о ( 1, I, 0) и аналогично a2 и a3; здесь а – межатомное расстояние.
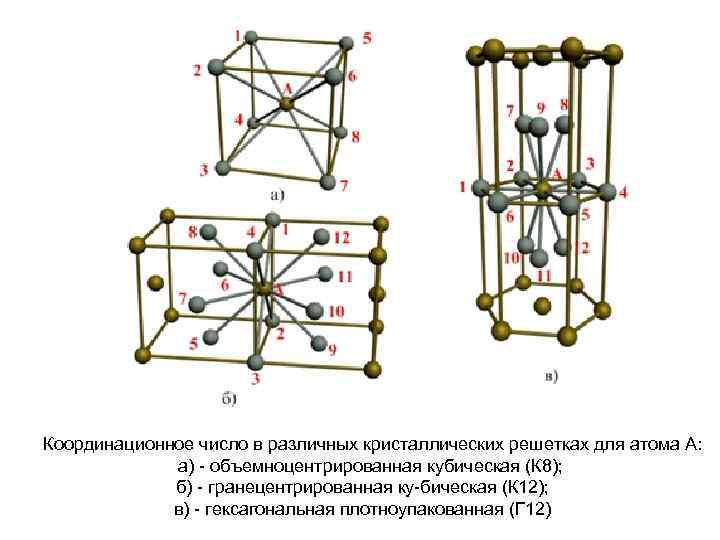
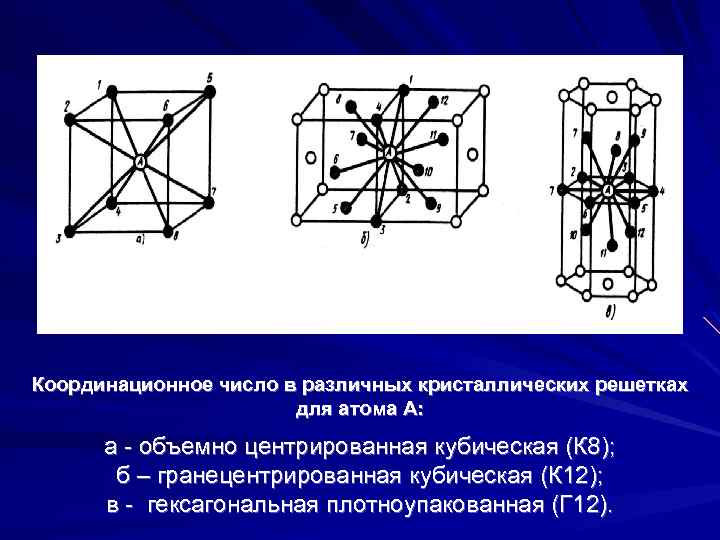
В кубической гранецентрированной решетке ( At) атомы располагаются по вершинам элементарной ячейки и в центрах ее граней ( фиг. Каждый атом в этой решетке окружен двенадцатью ближайшими соседями, располагающимися на одинаковых расстояниях, равных а / / – 2 ( 0 707 а), где а – ребро элементарной ячейки. Вторые ближайшие соседи ( в данной решетке их шесть) располагаются на значительно больших расстояниях, равных а. Рассматриваемая структура содержит два типа пустот ( междоузлий), в которых могут располагаться более мелкие атомы других элементов. Наибольшие междоузлия, или пустоты, находятся в центре куба и посредине его ребер, как показано на фиг.
В кубической гранецентрированной решетке ( см. рис. 61) возникают занятые атомами дополнительные промежуточные плоскости ( 200) и ( 220), О.
В кубической гранецентрированной решетке ( Ai) атомы располагаются по вершинам элементарной ячейки и в центрах ее граней ( фиг. Каждый атом в этой решетке окружен двенадцатью ближайшими соседями, располагающимися на одинаковых расстояниях, равных а / [ / – 2 – ( 0 707 а), где а – ребро элементарной ячейки. Вторые ближайшие соседи ( в данной решетке их шесть) располагаются на значительно больших расстояниях, равных а. Рассматриваемая структура содержит два типа пустот ( междоузлий), в которых могут располагаться более мелкие атомы других элементов. Наибольшие междоузлия, или пустоты, находятся в центре куба и посредине его ребер, как показано на фиг.
В кубической гранецентрированной решетке нитрида Mo2N атомы азота расположены в октаэдрических пустотах.
Расчеты для кубической гранецентрированной решетки, составленной из кластеров Сбо, показывают, что 8 ближайших соседей пробного кластера взаимодействуют с ним почти оптимальным образом ( т.е. контакт осуществляется через шестиугольники) так, что энергия взаимодействия составляет 28 кДж / моль, а расстояние между центрами – 0 983 нм.
Сплавы имеют кубическую гранецентрированную решетку, параметр которой проходит через минимум при – 60 ат. В этой же точке минимальна скорость суммарного превращения этилена.
Наличие порядка в расположении частиц
В аморфном веществе, в отличие от кристаллического, отсутствует какой-либо порядок в расположении частиц. Если же в кристаллическом веществе мысленно соединить прямой два близкоросположенных друг к другу атома, то можно обнаружить, что на этой линии на строго определенных промежутках будут лежать одни и те же частицы:
Таким образом, в случае кристаллических веществах можно говорить о таком понятии, как кристаллическая решетка.
Кристаллической решеткой называют пространственный каркас, соединяющий точки пространства, в которых находятся частицы, образующие кристалл.
Точки пространства, в которых находятся образующие кристалл частицы, называют узлами кристаллической решетки.
В зависимости от того, какие частицы находятся в узлах кристаллической решетки, различают: молекулярную, атомную, ионную и металлическую кристаллические решетки.
В узлах молекулярной кристаллической решетки Кристаллическая решетка льда Кристаллическая решетка льда как пример молекулярной решетки
находятся молекулы, внутри которых атомы связаны прочными ковалентными связями, однако сами молекулы удерживаются друг возле друга слабыми межмолекулярными силами. Вследствие таких слабых межмолекулярных взаимодействий кристаллы с молекулярной решеткой являются непрочными. Такие вещества от веществ с иными типами строения отличаются существенно более низкими температурами плавления и кипения, не проводят электрический ток, могут как растворяться, так и не растворяться в различных растворителях.
Растворы таких соединений могут как проводить, так и не проводить электрический ток в зависимости от класса соединения. К соединениям с молекулярной кристаллической решеткой относятся многие простые вещества — неметаллы (отвержденные H2, O2, Cl2, ромбическая сера S8, белый фосфор P4), а также многие сложные вещества – водородные соединения неметаллов, кислоты, оксиды неметаллов, большинство органических веществ. Следует отметить, что, если вещество находится в газообразном или жидком состоянии, говорить о молекулярной кристаллической решетке неуместно: корректнее использовать термин — молекулярный тип строения.
кристаллическая решетка алмаза Кристаллическая решетка алмаза как пример атомной решетки В узлах атомной кристаллической решетки
находятся атомы. При этом все узлы такой кристаллической решетки «сшиты» между собой посредством прочных ковалентных связей в единый кристалл. Фактически, такой кристалл является одной гигантской молекулой. Вследствие особенностей строения все вещества с атомной кристаллической решеткой являются твердыми, обладают высокими температурами плавления, химически мало активны, не растворимы ни в воде, ни в органических растворителях, а их расплавы не проводят электрический ток. Следует запомнить, что к веществам с атомным типом строения из простых веществ относятся бор B, углерод C (алмаз и графит), кремний Si, из сложных веществ — диоксид кремния SiO2 (кварц), карбид кремния SiC, нитрид бора BN.
У веществ с ионной кристаллической решеткой в узлах решетки находятся ионы, связанные друг с другом посредством ионных связей.
Поскольку ионные связи достаточно прочны, вещества с ионной решеткой обладают сравнительно высокой твердостью и тугоплавкостью. Чаще всего они растворимы в воде, а их растворы, как и расплавы проводят электрический ток. К веществам с ионным типом кристаллической решетки относятся соли металлов и аммония (NH4+), основания, оксиды металлов. Верным признаком ионного строения вещества является наличие в его составе одновременно атомов типичного металла и неметалла.
Кристаллическая решетка хлорида натрия
Кристаллическая решетка хлорида натрия как пример ионной решетки Однако следует отметить, что в веществах с ионным типом строения нередко можно обнаружить, помимо ионных, также ковалентные полярные связи. Это наблюдается в случае сложных ионов, т.е. состоящих из двух или более химических элементов (SO42-, NH4+, PO43- и т.д.). Внутри таких сложных ионов атомы связаны друг с другом ковалентными связями.
Металлическая кристаллическая решетка
наблюдается в кристаллах свободных металлов, например, натрия Na, железа Fe, магния Mg и т.д. В случае металлической кристаллической решетки, в ее узлах находятся катионы и атомы металлов, между которыми движутся электроны. При этом движущиеся электроны периодически присоединяются к катионам, таким образом нейтрализуя их заряд, а отдельные нейтральные атомы металлов взамен «отпускают» часть своих электронов, превращаясь, в свою очередь, в катионы. Фактически, «свободные» электроны принадлежат не отдельным атомам, а всему кристаллу.
Определение кристаллической решетки
Как мы знаем, все материальные вещества могут пребывать в трех базовых состояниях: жидком, твердом, и газообразном. Правда есть еще состояние плазмы, которое ученые считают ни много ни мало четвертым состоянием вещества, но наша статья не о плазме. Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
Общие сведения
Твердые тела по своим свойствам и структуре обычно классифицируются на кристаллические и аморфные. Это разделение обусловлено разным положением в них ионов, атомов или молекул. Частицы аморфных тел распределяются хаотично. Такое строение придает им изотропность и делает невозможным иметь фиксированную температуру плавления. К аморфным материалам относятся воск, полимеры и пластики, затвердевшие смолы.
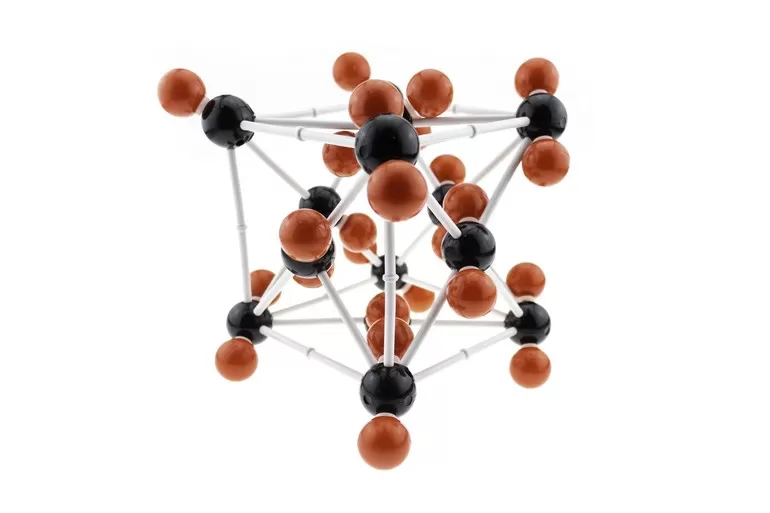
В кристаллическом веществе частицы выстраиваются в строго определенном порядке и образуют структуры, периодически повторяющиеся по всему его объему. Это придает материалу анизотропическое соответствие. Пространственное отображение такого строения — кристаллическая решетка. Она не является статичной, ее молекулы или атомы постоянно колеблются около положений равновесия. Состоит из узлов, в которых находятся частицы вещества, и соединяющих их воображаемых линий. Узлы образуются молекулами, атомами или ионами. Линии обозначают химические связи между этими частицами.
Существование решеток обусловлено тем, что только при условии периодичности в трехмерном пространстве достигается минимальное значение потенциальной энергии системы путем уравновешивания сил отталкивания и притяжения между атомами. Они бывают ионными, металлическими, ковалентными полярными и неполярными.
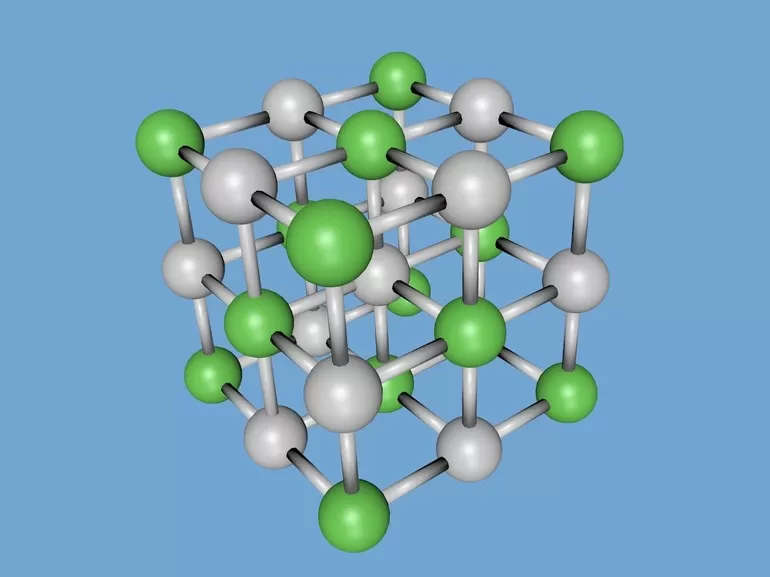
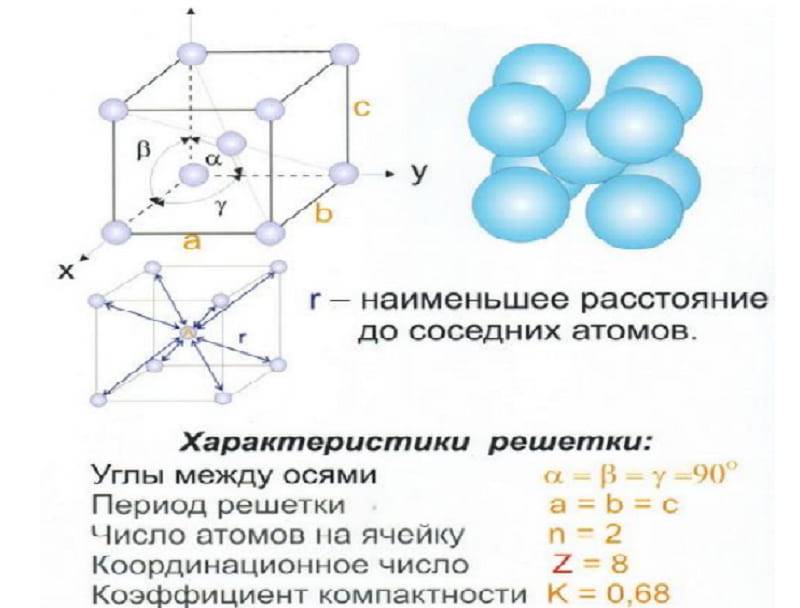
Наименьший фрагмент решетки считается элементарной ячейкой. Построить полную структуру материала можно так — перенести параллельно элементарную ячейку в любом направлении. Компактность и заполненность такой ячейки — важная характеристика, которая определяет химические и физические свойства вещества. Описывается такими показателями: число атомов в ней, плотность упаковки и параметр, т. е. расстоянием между ближайшими частицами. Параметр измеряется в нанометрах и вычисляется при помощи рентгеноструктурного анализа.
Как «упаковываются» слои кристаллической решетки?
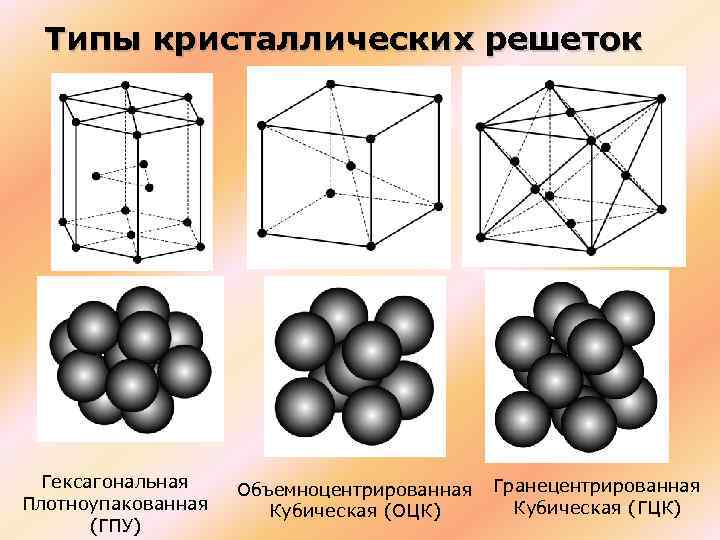
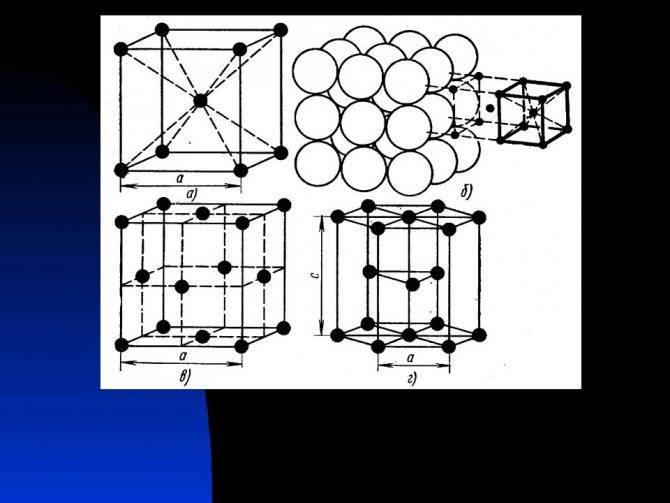
Представим, есть слои А и В. При гексагональной упаковке слои можно укладывать несколькими способами, и при этом образуется гексагональная плотная упаковка или гранецентрированная кубическая упаковка. Соблюдается условие: каждый шар верхнего слоя касается 3х шаров нижнего. Шары 3го слоя расположены четко над шарами 1го слоя, шары 4го – над 2ыми и т.д.
Более сложное строение имеет гексагональная кубическая упаковка (ГКУ) – шары 3го слоя находятся над промежутками 2го слоя, и поэтому слои С и А имеют существенные различия.
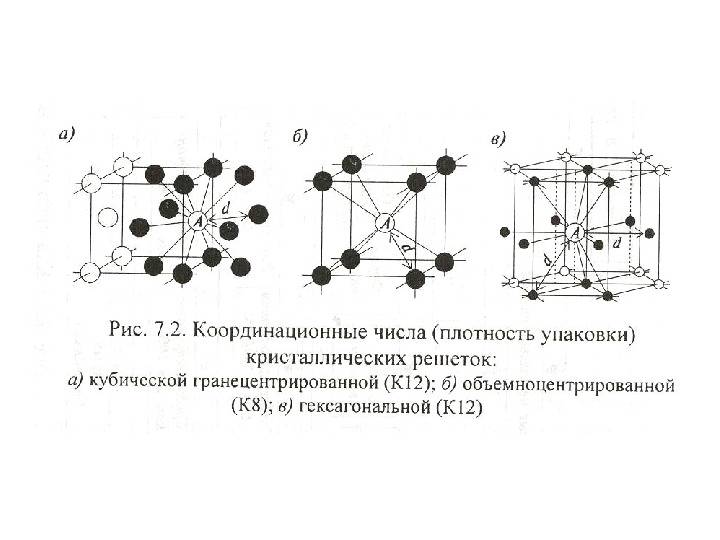
Объемно центрированная кубическая упаковка складывается только одним способом: каждый шар находится в центре куба, вершины которого заняты другими шарами, т.е. каждый шар касается 8-ми соседних, при этом принято говорить о том, что каждый атом имеет координационное число, равное 8.
Гексагональная плотная упаковка
Гранецентрированная кубическая упаковка
Объемно центрированная кубическая упаковка
Если говорить о координационных числах гранецентрированная кубическая упаковка и гексагональная плотная упаковка, то оно равно 12.
В пространстве можно эти типы упаковок представить так:
Гексагональная плотная упаковка
Гранецентрированная кубическая упаковка
Объемно центрированная кубическая упаковка
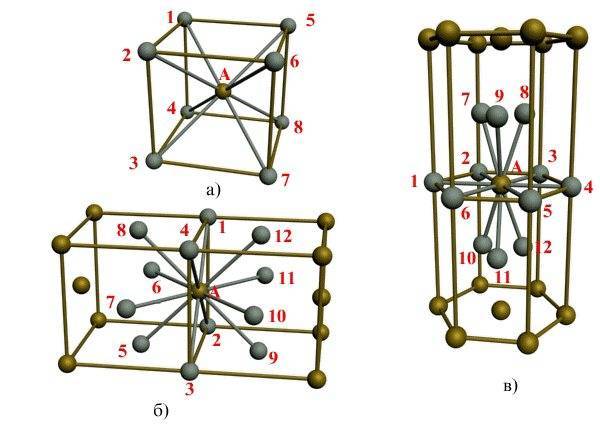
Пустоты в элементарной ячейке
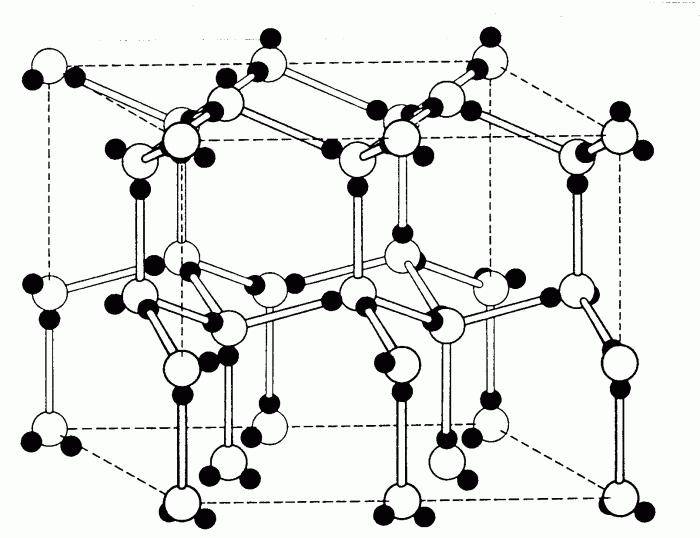
Визуализация кубической элементарной ячейки алмаза: 1. Компоненты элементарной ячейки, 2. Одна элементарная ячейка, 3. Решетка из 3 x 3 x 3 элементарных ячеек.
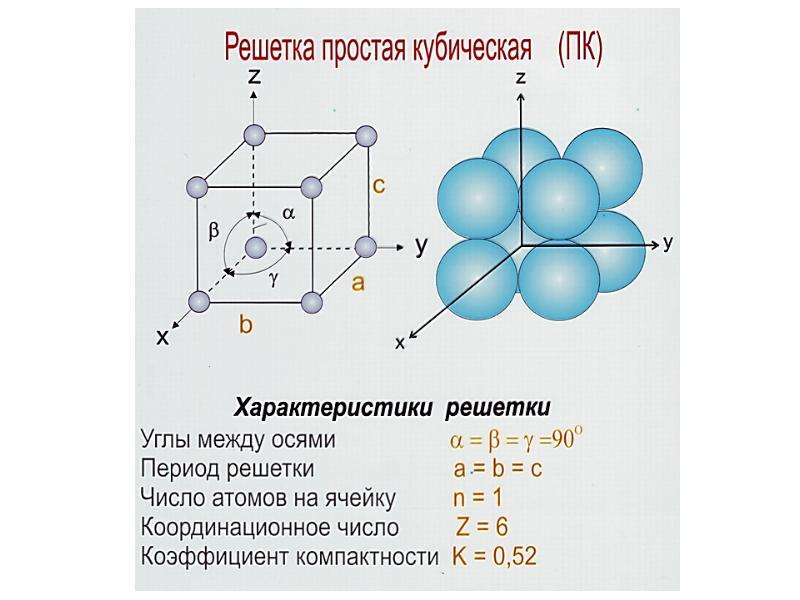
Простая кубическая элементарная ячейка имеет одну кубическую пустоту в центре.
Центрированный на теле кубический элементарная ячейка имеет шесть восьмигранный пустоты, расположенные в центре каждой грани элементарной ячейки, и двенадцать дополнительных, расположенных в середине каждого края той же ячейки, всего шесть октаэдрических пустот. Дополнительно есть 24 четырехгранный пустоты, расположенные в квадрате вокруг каждой октаэдрической пустоты, всего двенадцать чистых тетраэдрических пустот. Эти тетраэдрические пустоты не являются локальными максимумами и технически не являются пустотами, но иногда они появляются в многоатомных элементарных ячейках.
Гранецентрированная кубическая элементарная ячейка имеет восемь тетраэдрических пустот, расположенных на полпути между каждым углом и центром элементарной ячейки, в общей сложности восемь чистых тетраэдрических пустот. Вдобавок есть двенадцать октаэдрических пустот, расположенных в средних точках краев элементарной ячейки, а также одно октаэдрическое отверстие в самом центре ячейки, всего четыре чистых октаэдрических пустот.
Одной из важных характеристик кристаллической структуры является ее фактор упаковки атомов. Это рассчитывается исходя из предположения, что все атомы являются идентичными сферами с достаточно большим радиусом, чтобы каждая сфера упиралась в следующую. Фактор упаковки атомов – это доля пространства, заполненного этими сферами.
Предполагая, что один атом на точку решетки, в примитивной кубической решетке с длиной стороны куба а, радиус сферы будета⁄2 а фактор упаковки атомов оказывается около 0,524 (что довольно мало). Точно так же в скрытая копия решетки атомная упаковка составляет 0,680, а в fcc это 0,740. В fcc ценность – это максимальное теоретически возможное значение для любой решетки, хотя есть и другие решетки, которые также достигают того же значения, например гексагональная плотноупакованная (hcp) и один вариант тетраэдрального скрытая копия.
Как правило, поскольку атомы в твердом теле притягиваются друг к другу, более плотно упакованные атомы обычно встречаются. (Однако могут иметь место неплотно упакованные устройства, например, если орбитальная гибридизация требует определенных валентные углы.) Соответственно, примитивная кубическая структура с особенно низким фактором упаковки атомов встречается редко в природе, но встречается в полоний. В скрытая копия и fccс их более высокой плотностью, оба довольно распространены в природе. Примеры скрытая копия включают утюг, хром, вольфрам, и ниобий. Примеры fcc включают алюминий, медь, золото и Серебряный.
Общее понятие о металлах
«Химия. 9 класс» — это учебник, по которому проходят обучение школьники. Именно в нем подробно изучаются металлы. Рассмотрению их физических и химических свойств отведена большая глава, ведь разнообразие их чрезвычайно велико.
Именно с этого возраста рекомендуют давать детям представление о данных атомах и их свойствах, ведь подростки уже вполне могут оценить значение подобных знаний. Они прекрасно видят, что окружающее их разнообразие предметов, машин и прочих вещей имеет в своей основе как раз металлическую природу.
Что же такое металл? С точки зрения химии, к данным атомам принято относить те, что имеют:
- малое число электронов на внешнем уровне;
- проявляют сильные восстановительные свойства;
- имеют большой атомный радиус;
- как простые вещества обладают рядом специфических физических свойств.
Основу знаний об этих веществах можно получить, если рассмотреть атомно-кристаллическое строение металлов. Именно оно объясняет все особенности и свойства данных соединений.
В периодической системе для металлов отводится большая часть всей таблицы, ведь они образуют все побочные подгруппы и главные с первой по третью группу. Поэтому их численное превосходство очевидно. Самыми распространенными являются:
- кальций;
- натрий;
- титан;
- железо;
- магний;
- алюминий;
- калий.
Все металлы имеют ряд свойств, которые позволяют объединять их в одну большую группу веществ. В свою очередь, эти свойства объясняет именно кристаллическое строение металлов.
Смотреть галерею
Признаки
Все 14 видов элементарных ячеек обладают общими свойствами:
- они являются простейшими повторяющимися структурами в кристалле;
- каждый центр решетки состоит из одной частицы, называемый узлом решетки;
- узлы ячейки соединяются между собой прямыми, которые формируют геометрию кристалла;
- противоположные грани параллельны;
- симметрия элементарной структуры соответствует симметрии всей кристаллической решетки.
При выборе структуры элементарной ячейки руководствуются некоторыми правилами. У нее должны быть:
- наименьший объем и площадь;
- наибольшее количество одинаковых ребер и углов между ними;
- прямые углы (по возможности);
- пространственная симметрия, отражающая симметрию всей кристаллической решетки.
Компактность
Компактности или плотность, то есть доля пространства , занимаемые атомы, из граней кубических сеток является:
противзнак равноVолтыме опротивпротивтыпе´Полный объемзнак равно4×Vвтомев3знак равно4×(43⋅πр3)(4р2)3знак равноπ26≃,74{\ displaystyle c = {\ frac {\ mathrm {Объем ~ занято {\ sharp {e}}}} {\ text {Общий объем}}} = {\ frac {4 \ times V_ {atom}} {a ^ { 3}}} = {\ frac {4 \ times ({\ frac {4} {3}} \ cdot \ pi R ^ {3})} {\ left ({\ frac {4R} {\ sqrt {2}) }} \ right) ^ {3}}} = {\ frac {\ pi {\ sqrt {2}}} {6}} \ simeq 0.74}
Это максимально возможная плотность, также достигаемая компактной гексагональной сеткой (см . Гипотезу Кеплера ).


![Кубическая кристаллическая системасодержание а также решетки браве [ править ]](https://benzo-electro-instrument.ru/wp-content/uploads/b/b/d/bbdb2f1d97e14ab661432590969aab61.jpeg)