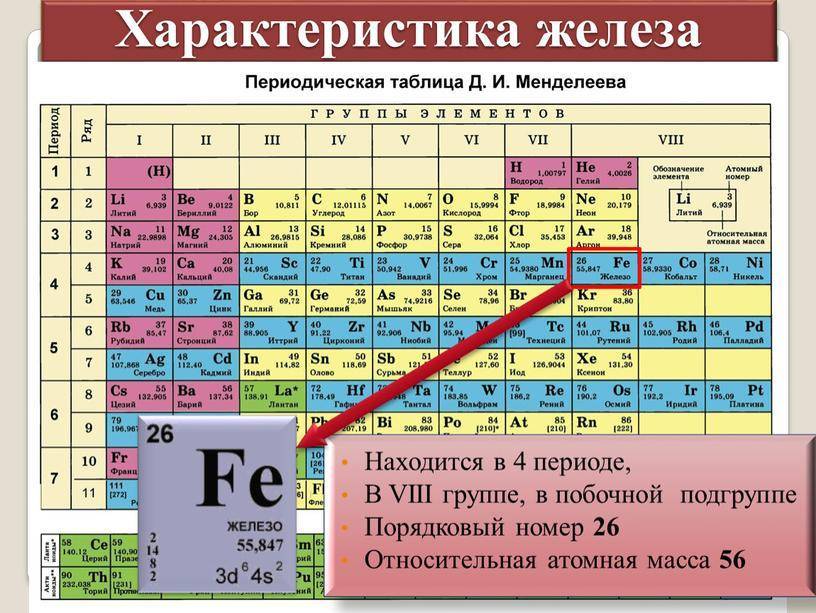
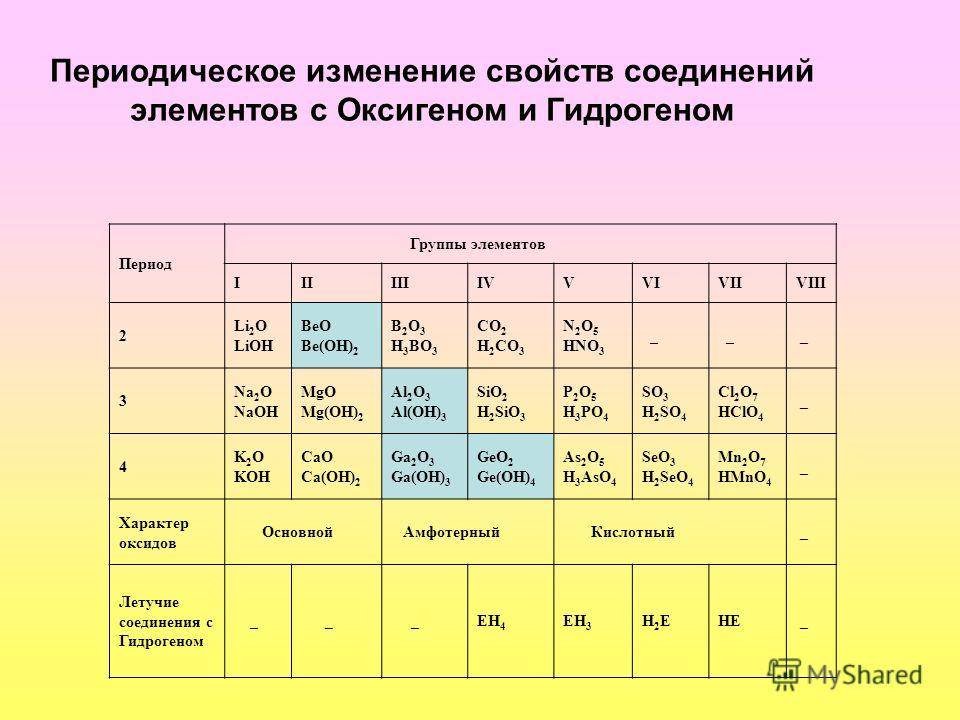
Что такое лантаноиды
Лантаноиды – это химические элементы, которые можно найти в серии лантаноидов блока f в периодической таблице элементов. Лантаноиды нерадиоактивны, за исключением прометия. Поскольку атомные номера лантаноидов находятся в диапазоне от 57 до 71, они также состоят из сравнительно больших атомов. Валентные электроны лантаноидов находятся на 4f орбитали. Их также называют Лантаноиды.
Лантаноиды являются металлами и имеют яркий и серебристый вид. Они очень мягкие и даже могут быть порезаны ножом. Элементы лантана, церия, празеодима, неодима и европия серии лантаноидов обладают высокой реакционной способностью по сравнению с другими элементами. Когда эти металлы подвергаются воздействию воздуха, они образуют покрытия из оксидов. По этой причине они запятнаны.
Лантаноиды быстро реагируют с горячей водой, но медленно с холодной водой. Когда эти металлы загрязнены другими металлами, такими как кальций, они быстро разъедают. Но когда лантаноиды загрязняются неметаллами, такими как азот и кислород, они становятся хрупкими. Эти загрязнения изменяют температуру кипения лантаноидов.
Лантаноиды быстро растворяются в кислотах. Они могут реагировать с кислородом и галогенидами, но медленно. Наиболее заметное состояние окисления лантаноидов – +3. Другие состояния окисления, которые показывают Лантаноиды, +2 и +4. Но они не могут иметь степень окисления +6. Следовательно, они не могут образовывать сложные молекулы. Лантаноиды не образуют оксокатионов, таких как оксиды и гидроксиды. Молекулы, образованные лантаноидами, являются менее основными.
Рисунок 1: нитраты лантаноидов
Почти все ионы, образованные лантаноидами, бесцветны. Лантаноиды являются электроположительными элементами. Поэтому они предпочитают формировать молекулы с электроотрицательными элементами. Тем не менее, изменения в химических и физических свойствах очень меньше на протяжении всей серии.
характеристики
Кристаллическая структура лантаноидов, кроме церия, самария, европия и иттербия.
Физические свойства
Лантаноиды – это блестящие, серебристые, относительно мягкие и химически активные металлы. Практически все они имеют наиболее плотную упаковку сфер , характерную для металлов . Твердость увеличивается с увеличением атомного номера.
Подобно актинидам , лантаноиды принадлежат к внутренним переходным элементам или элементам f-блока , поскольку f-орбитали в этих рядах не полностью заполнены электронами.
Все изотопы прометия нестабильны, то есть радиоактивны.
Химические свойства
Из-за схожей структуры валентной оболочки лантаноиды химически ведут себя как элементы 3-й группы скандия и иттрия периодической таблицы и вместе с ними образуют группу редкоземельных элементов . На воздухе они быстро окисляются и тускнеют. Они более или менее быстро реагируют с водой с образованием водорода .
Начиная с Cer, постепенно заполняется орбиталь 4f. В случае лютеция он полностью занят 14 электронами. Поскольку 4f-орбитали лежат глубоко внутри атомов , они мало влияют на химическое поведение в отличие от d-орбиталей других элементов подгруппы. Таким образом, элементы лантаноидов относительно схожи по своим химическим свойствам. Они настолько похожи, что когда в 1794 году была открыта эта земля, их даже считали оксидом одного и того же элемента. То же самое относится и к многочисленным компонентам церитовой земли. Их объединяет степень окисления +3. Кроме того, у некоторых элементов встречаются степени окисления +2 и +4.
Нарушение непрерывности ионных радиусов между гадолинием и тербием называется разрывом гадолиния в лантаноидах. Это объясняет, почему, несмотря на схожесть лантаноидов, химическое поведение элементов меняется после гадолиния. На химическое поведение можно легко повлиять на разрыв гадолиния. Следа америция достаточно, чтобы комплекс тербия приобрел структурный тип более легких лантаноидов.
Цвета ионов лантаноидов в водном растворе
| Число окисления | 57 год | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| +2 | Sm 2+ кроваво-красный | Eu 2+ бесцветный | Тм 2+ пурпурно-красный | Yb 2+ желто-зеленый | |||||||||||
| +3 | La 3+ бесцветный | Ce 3+ бесцветный | Пр 3+ желто-зеленый | Nd 3+ фиолетовый | PM 3+ фиолетовый розовый | Sm 3+ темно-желтый | Eu 3+ бесцветный | Gd 3+ бесцветный | TB 3+ бесцветный | Dy 3+ желто-зеленый | Ho 3+ желтый | He 3+ темно-розовый | TM 3+ бледно-зеленый | Yb 3+ бесцветный | Лю 3+ бесцветный |
| +4 | Ce 4+ оранжево-желтый | Пр 4+ желтый | Nd 4+ сине-фиолетовый | TB 4+ красно-коричневый | Dy 4+ оранжево-желтый |
Химические свойства лантаноидов
Задача 1061.
Чем объясняется сходство химических свойств лантаноидов?Решение:
К семейству лантаноидов принадлежат четырнадцать f-элементов, следующих в периодической системе после лантана (элементы № 58 – № 71). С возрастанием порядкового номера элементов этого семейства происходит заполнение электронами подуровня третьего снаружи электронного слоя (4f-подуровня), строение же наружного, а у некоторых элементов и следующего за ним слоёв, остаются неизменными. По этой причине все лантаноиды очень близки друг к другу по химическим свойствам. Электроны заполняют 4f-, а не 5-дуровень потому, что в этом случае они обладают меньшей энергией. Однако разница в энергиях 4f- и 5d-состояний очень мала. Благодаря этому один из 4f-элементов (у некоторых, например, у церия, два 4f-электрона) легко возбуждаются, переходя на 5d-подуровень. Поэтому в большинстве своих соединений лантаноиды имеют степень окисления +3, а не +2. Это обстоятельство объясняет близость свойств лантаноидов и скандия. Лантаноиды образуют сульфиды, хлориды, оксиды – солеподобные, нерастворимые, тугоплавкие соединения. Гидроксиды М(ОН)3 – сильные основания. Катионы М3+ сильно гидратируются. С анионами одноосновных кислот и серной кислотой лантаноиды дают растворимые соли. Лантаноиды образуют многочисленные комплексные соединения. Соли их имеют различное яркое окрашивание, что возможно объяснить переходом 4f-электрона на 5d-подуровень.
Лантаноидное сжатие
Задача 1062.
Что такое лантаноидное сжатие? Как оно сказывается на свойствах d-элементов 6 периода?Решение:
С ростом атомного номера у лантаноидов наблюдается значительное уменьшение металлических и ионных радиусов (от 102 пм у церия Се до 96,1 пм у лютеция Lu). Это явление называется лантаноидным сжатием. Оно является причиной значительного роста плотности лантаноидов: от 6,19 у лантана La до 9,87 у лютеция Lu.
Основная причина лантаноидного сжатия заключается в недостаточном экранировании заряда ядра электронами 4f-орбитали.
В атомах, обладающих единственным электроном, среднее расстояние между ядром и электроном определяется электронной орбиталью, на которой находится электрон, и уменьшается с ростом заряда ядра, тем самым приводя к уменьшению величины атомного радиуса. атомах, обладающих более чем одним электроном, степень уменьшения атомного радиуса вследствие увеличения заряда ядра ослабляется вследствие увеличения электростатического отталкивания между электронами.
Индивидуальные доказательства
- Вольфганг Либшер, Эккехард Флюк: Систематическая номенклатура неорганической химии . Springer-Verlag, Берлин 1999, ISBN 3-540-63097-X .
- Номенклатура неорганической химии, Рекомендации ИЮПАК 2005 .
- AM Mariano: Экономическая геология редкоземельных минералов . В: Б. Р. Липин, Г. А. Маккей (ред.): Обзоры по минералогии , том 21 – Геохимия и минералогия редкоземельных элементов (1989). Опубликовано Минералогическим обществом Америки, ISBN 0-939950-25-1 , стр. 309-337.
- Георг Штайнхаузер : Структурная химия – Прикосновение к пустоте. В кн . : Новости химии. 66, 2018, стр 118,. DOI : .
- А. Ф. Holleman , Е. Wiberg , Н. Wiberg : Учебник неорганической химии . 102-е издание. Вальтер де Грюйтер, Берлин 2007, ISBN 978-3-11-017770-1 , стр. 1937.
- ДТВ атлас по химии . 1981 , часть 1. С. 220.
- ↑
Распространение в природе
Оксиды актиноидов и лантаноидов часто называют циркониевой, ториевой, иттриевой землями. Они являются основным источником для получения соответствующих металлов. Уран, как главный представитель актиноидов, находится в наружном слое литосферы в форме четырёх видов руд или минералов. Прежде всего, это урановая смолка, представляющая собой двуокись урана. В ней содержание металла самое высокое. Часто диоксиду урана сопутствуют радиевые месторождения (жилы). Они встречаются в Канаде, Франции, Заире. Комплексы ториевой и урановой руды часто содержат руды других ценных металлов, например золота или серебра.

Запасами такого сырья богаты Россия, Южно-Африканская республика, Канада и Австралия. В некоторых осадочных породах содержится минерал карнотит. В его состав, кроме урана, входит еще и ванадий. Четвертый вид уранового сырья – это фосфатные руды и железоурановые сланцы. Их запасы находятся в Марокко, Швеции и США. В настоящее время перспективными считаются также залежи лигнитов и каменного угля, содержащие примеси урана. Их добывают в Испании, Чехии, а также в двух американских штатах – Северной и Южной Дакоте.
– Источник
Лантан без лантаноидов
Как ни грустно сознавать, герой нашего рассказа — личность вполне заурядная. Это металл, обыкновенный по внешнему виду (серебристо-белый, покрытый сероватой окисной пленкой) и по физическим свойствам: температура плавления 920, кипения 3469° С; по прочности, твердости, электропроводности и прочим характеристикам металл лантан всегда оказывается в середине таблиц. Обыкновенен лантан и по химическим свойствам. В сухом воздухе он не изменяется — окисная пленка надежно защищает от окисления в массе. Но если воздух влажен (а в обычных земных условиях он влажен почти всегда), металлический лантан постепенно окисляется до гидроокиси. La(OH)3 — основание средней силы, что опять-таки характерно для металла-«середнячка».
церий
Новый элемент, обнаруженный в церите и мозандерите, по предложению Берцелиуса назвали лантаном. Название с намеком: оно происходит от греческого A,av0dveiv — скрываться, забываться. Лантан, содержащийся в церите, успешно скрывался от химиков в течение 36 лет! Долгое время считали, что лантан двухвалентен, что он аналог кальция и других щелочноземельных металлов, а его атомный вес равен 90—94. В правильности этих цифр не сомневались до 1869 г. Менделеев же увидел, что во II группе периодической системы редкоземельным элементам нет места и поставил их в III группу, приписав лантану атомный вес 138—139. Но правомерность такого перемещения еще надо было доказать. Менделеев предпринял исследование теплоемкости лантана. Полученная им величина прямо указывала на то, что этот элемент должен быть трехвалентным… Металлический лантан, разумеется, далеко не чистый, впервые был получен Мозандером при нагревании хлористого лантана с калием. В наше время в промышленных масштабах получают лантан чистотой более 99%. Проследим, как это делается, но прежде познакомимся с главными минералами лантана и первыми стадиями сложнейшего процесса разделения редкоземельных элементов. Уже упоминалось, что в минералах лантан и лантаноиды неизменно сопутствуют друг другу. Есть минералы селективные, в которых доля того или иного редкоземельного элемента больше, чем обычно. Но нет минералов чисто лантановых или чисто цериевых, не говоря уже о других лантаноидах. Примером селективного лантанового минерала может служить давидит, в котором до 8,3% Lа203 и лишь 1,3% окиси церия. Но получают лантан преимущественно из монацита и бастнезита, как, впрочем, и церий, и все остальные элементы цериевой подгруппы. Монацит — тяжелый блестящий минерал, обычно желто-бурый, но иногда и других цветов, поскольку постоянством состава он не отличается. Точнее всего его состав описывает такая странная формула: (РЗЭ)Р04. Она означает, что монацит — фосфат редкоземельных элементов (РЗЭ). Обычно в монаците 50—68% окислов РЗЭ и 22—31,5% Ра05. А еще в нем до 7% двуокиси циркония, 10% (в среднем) двуокиси тория и 0,1—0,3% урана. Эти цифры со всей очевидностью показывают, почему так тесно переплелись пути редкоземельной и атомной промышленности. Смешанный металл редких земель — мишметалл — и смесь их окислов начали применять в конце прошлого века, а в начале нынешнего в связи с ними был /продемонстрирован выдающийся образец международного воровства. Немецкие суда, доставлявшие грузы в Бразилию, собираясь в обратный путь, заполняли трюмы песком с пляжей Атлантического побережья этой страны, причем из определенных мест. Капитаны заявляли, что песок — это просто балласт, необходимый для большей устойчивости судна. В действительности же они, выполняя заказы германских промышленников, крали ценное минеральное сырье — прибрежные пески штата Эспириту-Санту, богатые монацитом… Монацитовые россыпи распространены по берегам рек, озер и морей на всех континентах. В начале века (данные за 1909 г.) 92% мировой добычи редкоземельного сырья, и прежде всего монацита, приходилось на долю Бразилии. Спустя десять лет центр тяжести переместился на тысячи километров к востоку (или к западу, смотря как считать) — в Индию. После 1950 г. в связи с развитием атомной промышленности гегемоном среди капиталистических стран в добыче и переработке редкоземельного сырья стали Соединенные Штаты.
циркона432Кадмий3празеодима
К 1965 г. внешнеторговые организации нашей страны могли предложить покупателям все лантаноиды в виде металлов чистотой выше 99%. Кроме прометия, разумеется, хотя радиоактивные препараты этого элемента — продукты ядерного распада урана — тоже стали вполне доступны. В каталоги «Техснабэкспорта» вошли также около 300 химически чистых и особо чистых соединений лантана и лантаноидов. Это свидетельство высокого уровня развития советской редкоземельной промышленности. Но вернемся к лантану.
Периодический закон
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».

Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
<<Форма демодоступа>>
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.

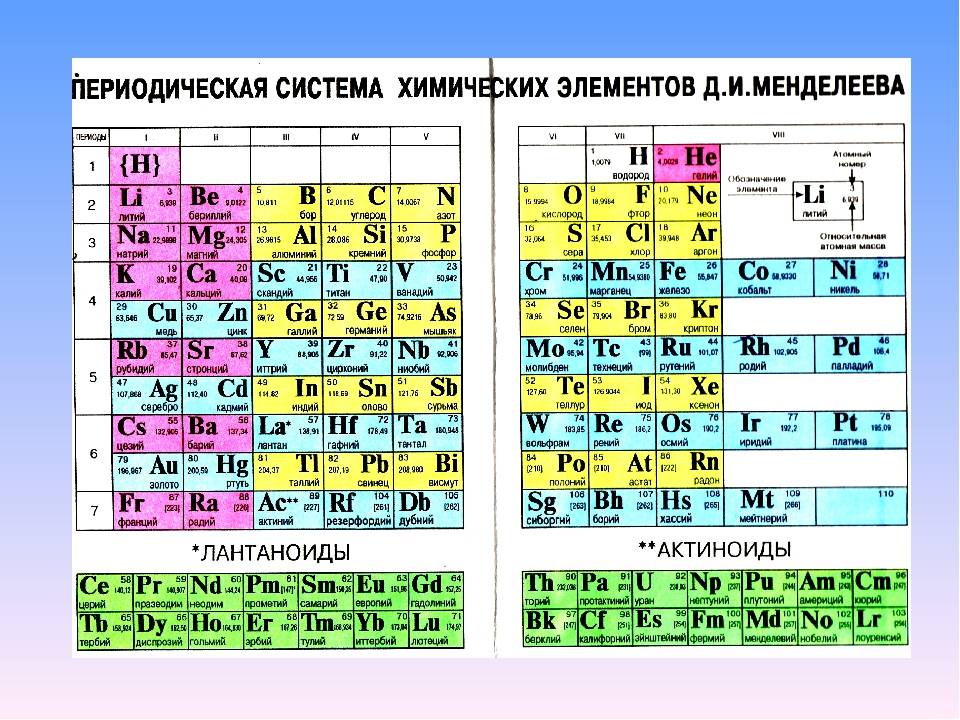
Первый вариант Периодической таблицы элементов, составленной Д.И. Менделеевым.
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
Общие способы получения металлов в промышленности
За исключением тория, протактиния и урана, которые добывают прямым путем из руд, остальные актиноиды можно получить путем облучения образцов металлического урана быстродвижущимися потоками нейтронов. В промышленных масштабах нептуний и плутоний добывают из отработанного топлива ядерных реакторов. Отметим, что получение актиноидов – это достаточно сложный и дорогостоящий процесс, основными методами которого являются ионный обмен и многостадийная экстракция. Лантаноиды, которые называют редкоземельными элементами, получают путем электролиза их хлоридов или фторидов. Чтобы добыть сверхчистые лантаноиды, используют металлотермический метод.

Химические свойства
Они образуют очень однородное семейство, характеризующееся прогрессивным заполнением электронного подслоя 4f. Таким образом, элементы принадлежат блоку f, за исключением самого тяжелого, лютеция 71 Lu, который принадлежит блоку d .
Лантаноиды часто нечетко обозначаются химическим псевдосимволом Ln. Вообще говоря, они очень электроположительны . По химическому составу они очень похожи на лантан – отсюда и их название. Для всех лантаноидов степень окисления +3 является наиболее стабильной, с непревзойденной однородностью в периодической таблице . Естественно и в своих наиболее распространенных синтетических соединениях лантаноиды находятся в форме трехвалентных катионов Ln 3+ , но все они также способны образовывать двухвалентные катионы Ln 2+ в растворе. Только церий 58 Ce (который имеет состояния +3 и +4) и европий 63 Eu (который имеет состояния +2 и +3) имеют другие легко доступные степени окисления, что также позволяет отделить эти элементы от других лантаноидов. . Лантаноиды тяжелее церия почти не достигают степени окисления +4. Это объясняется тем, что f-орбитали относительно внутренние: удалить f-электроны сложно. Их Ln 3+ trications называются трудно в смысле теории ЖМКО .
Ионный радиус из Ln 3+ катионов уменьшается , когда атомное число возрастает, явление , называемое сжатие лантанидов : Эффективность экранирования ядра электронов е орбитального действительно очень низок (порядок эффективность снижается на атомный орбитальное существо с> р> д> е ) и не в полной мере компенсировать увеличение заряда атомного ядра как атомные увеличивается число. По этой причине, ионный радиус Lu 3+ подобен тому из Y 3+ , хотя лютеция расположен в 6 – м периоде чуть выше иттрия , расположенной между тем в 5 – й раз в периодической таблице .
Свойства f-орбиталей означают, что содержащиеся в них электроны мало доступны для образования ковалентных связей . По этой причине ионы лантаноидов образуют комплексы без предпочтения их координационной геометрии . Катионы лантаноидов образуют координационные комплексы, в которых катион лантанида обычно окружен 8-10 донорными атомами, что является более высокой координацией, чем для катионов переходных металлов .
Неодима , то тербия и иттербия также имеют свойство образовывать с cyclooctatétraénure анионов , [С 8 Н 8 ] 2- , обозначается ТОС сэндвич соединений из типа М (СОТ) 2 , lanthanocène.
Энергия ионизации
Энергия ионизации лантаноидов может быть по сравнению с алюминием . Для последних сумма первых трех энергий ионизации составляет 5,139 кДж · моль -1 , в то время как эта сумма входит в интервал 3,455-4,186 кДж · моль -1 для лантаноидов, что согласуется с химически очень реактивный характер этих элементов: он минимален для лантана и максимален для иттербия, с локальным максимумом для европия, что соответствует частичному заполнению 4f подслоя для европия и насыщению этого подслоя иттербием. Эти два элемента образуют соли в степени окисления +2, в частности дигидриды . Таким образом, они имеют сходство с щелочноземельными металлами . Сумма первых двух энергий ионизации европия также составляет 1,632 кДж · моль -1 по сравнению с эквивалентной суммой бария , которая составляет 1 563,1 кДж · моль -1 .
Относительная легкость, с которой 4- й электрон может быть удален из церия и, в меньшей степени, празеодима, почему могут быть получены соединения церия ( IV ) и празеодима ( IV ): таким образом образуется диоксид церия CeO 2а не полуторный оксид Ce 2 O 3когда церий реагирует с кислородом O 2.
Разделение лантаноидов
Тот факт, что ионный радиус соседних лантаноидов очень похож, затрудняет их отделение друг от друга в природных рудах и, в более общем смысле, при смешивании. Раньше мы применяли каскадную и дробную кристаллизацию . Поскольку их радиус все еще немного отличается, энергия решетки их солей и энергия гидратации их ионов также немного отличаются, что приводит к небольшим различиям в растворимости. Для этой цели можно использовать соли общей формулы Ln (NO 3 ) 3 · 2NH 4 NO 3 · 4H 2 O. Например.
В промышленности лантаноиды разделяют жидкостно-жидкостной экстракцией . Они , как правило , экстрагируют из водного раствора из нитратов в керосине , содержащий трибутилфосфат (СН 3 СН 2 СН 2 СН 2 О) 3 PO. Образованные комплексы становятся все более и более стабильными по мере уменьшения ионного радиуса, так что растворимость органической фазы увеличивается. Полное разделение может осуществляться непрерывно за счет противоточного обмена (en) . Лантаноиды также можно разделить с помощью ионообменной хроматографии , используя тот факт, что константа стабильности для образования ЭДТА увеличивается с log K ≈ 15,5 для – до log K ≈ 19,8 для – .
§ 10. Периодический закон в свете теории строения атома
*Положение в периодической системе d- и f-элементов
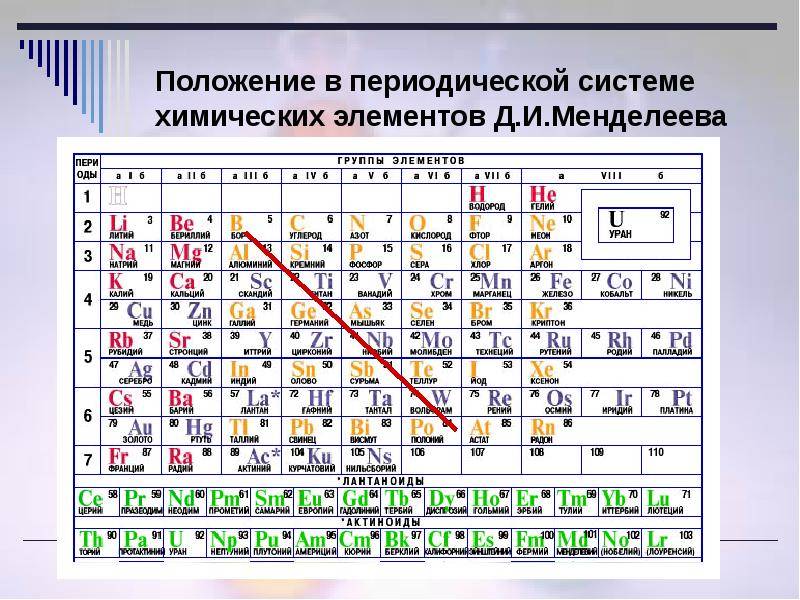
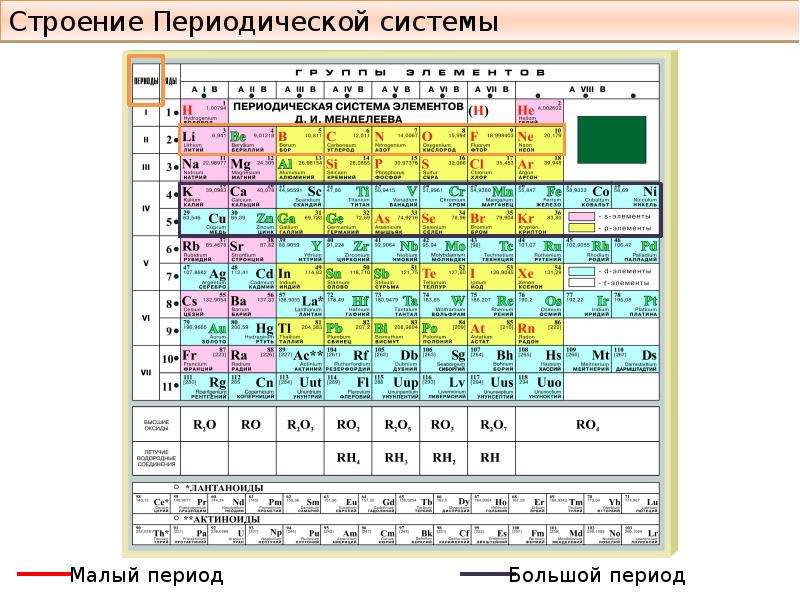
d– и f-Элементы относят к элементам B-групп. Так как эти элементы расположены в периодической системе между s– и p-элементами в 4–8-м периодах, их называют переходными.
В 4-м периоде (K — Kr) содержится 18 элементов. Ввиду большего числа элементов в этом периоде по сравнению с первыми тремя периодами Д. И. Менделеев назвал 4-й и последующие периоды большими.
Пятый период (Rb — Xe) построен аналогично 4-му: в нём также находится десять переходных d-элементов (Y — Cd).
Шестой период (Cs — Rn) содержит 32 элемента. В него, помимо десяти d-элементов (Lu — Hg), включено 14 f-элементов. Элементы от лантана (La) до иттербия (Yb) в виде отдельного ряда вынесены вниз таблицы, который получил название «лантаноиды» по его первому элементу — лантану. Лантаноиды сходны по химическим свойствам. Это объясняется тем, что электронами у них заполняются внутренние 4f-орбитали, а валентный электронный слой имеет похожую электронную конфигурацию — чаще всего 5d16s2. В соединениях лантаноиды проявляют преимущественно степень окисления +3.
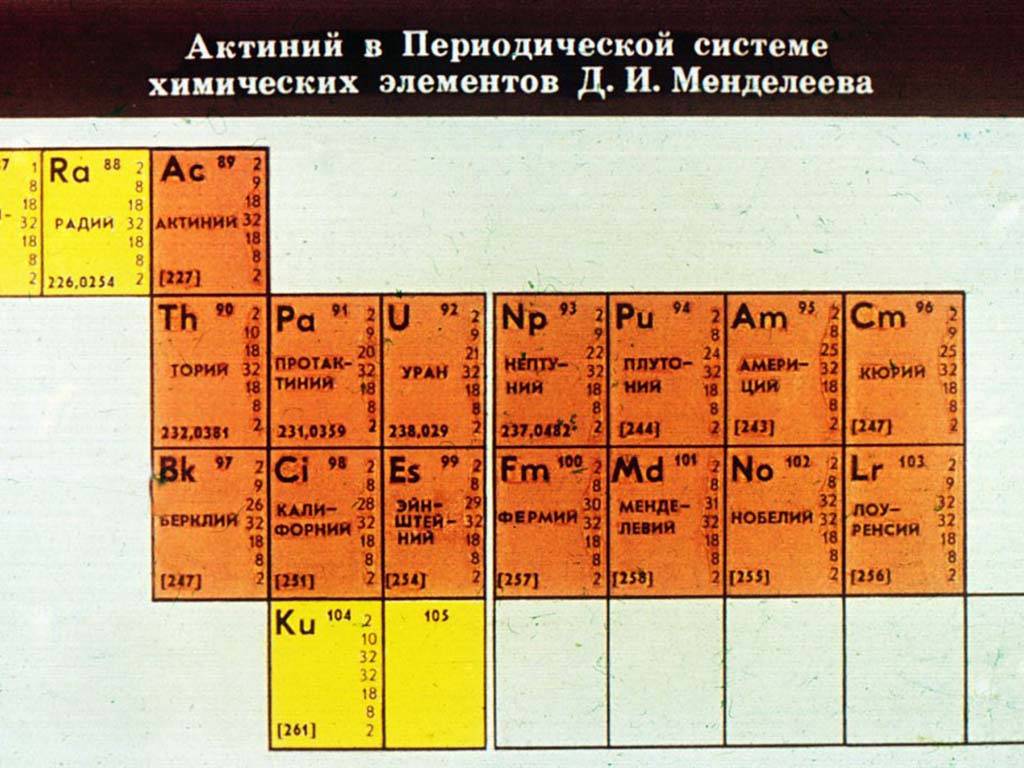
Седьмой период также содержит 32 элемента — от франция (Fr) до оганесона (Og). Период начинается с s-элементов (Fr и Ra), затем следуют 14 актиноидов (Ac — No). Эти элементы также вынесены в отдельный ряд внизу таблицы из-за близости их свойств, хотя они выражены меньше, чем у лантаноидов. Затем следуют десять 6d-элементов и шесть 6р-элементов. Все элементы этого периода являются радиоактивными, и большая их часть получена искусственным путём.
В периодической системе элементы разделены на группы. Две группы IA и IIA заполняют s-элементы. Далее располагаются десять В-групп, заполненных d-элементами. Завершают таблицу шесть А-групп, содержащих р-элементы.
Может ли быть открыто ещё больше химических элементов, чем известно сейчас? Ведь самые последние из известных элементов были открыты совсем недавно.
На этот вопрос отвечает теория ядерной физики. Пока с надёжностью предсказывают возможность существования химических элементов с порядковыми номерами до 126. В то же время есть научные концепции, которые предполагают искусственное получение химических элементов с порядковыми номерами до 173 с «островком стабильности» в области 164-го элемента.
У периодического закона нет привычного для физических законов математического выражения. Все попытки вывести математическую формулу периодического закона, предпринимавшиеся неоднократно, оказались безуспешными. В этом особенность свойств химических элементов и их соединений. Присущие им свойства не укладываются в простые математические выражения.
Своеобразной графической формой, выражающей периодический закон, стала периодическая система, которую Д. И. Менделеев представил в виде таблицы. По предложению ИЮПАК её так и называют: «Периодическая таблица элементов» (Periodic Table of the Elements), а у нас часто кратко: «Таблица Менделеева».
Таблица периодической системы — это иллюстрация закономерного расположения химических элементов относительно друг друга в периодической системе.
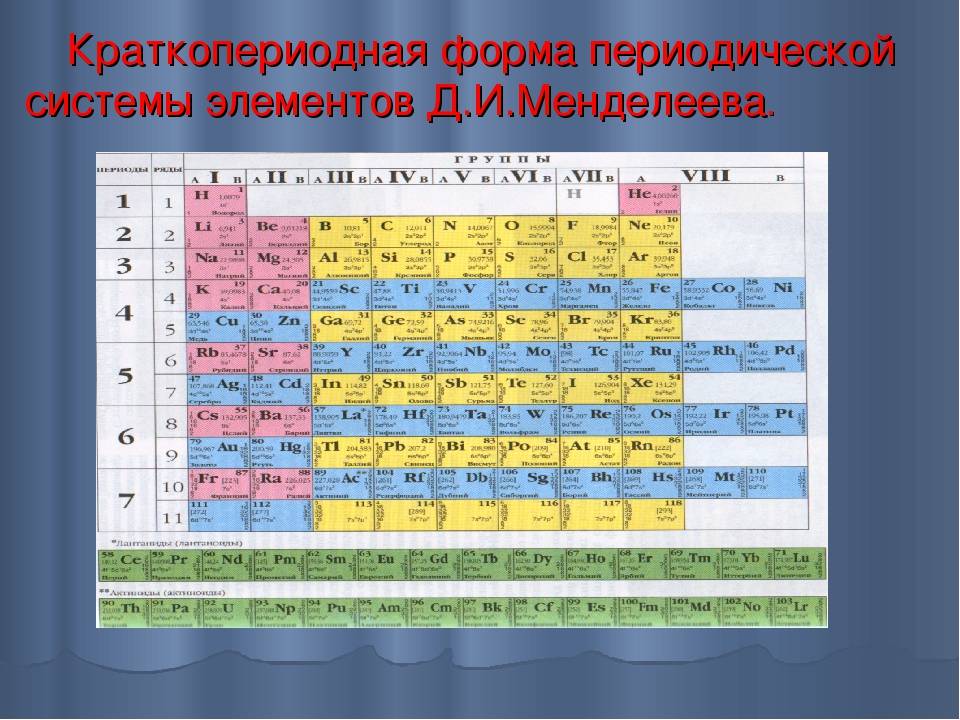
Менделеев посчитал более приемлемым представить периодическую систему в короткопериодной форме, которая в современном виде изображена на рисунке 20.1. В ней группы элементов подразделяются на подгруппы — главные и побочные. В главных подгруппах размещены s– и p-элементы, в побочных — d-элементы.
Рис. 20.1. Современный вариант короткопериодной периодической системы химических элементов
Позже ИЮПАК предложил использовать полудлиннопериодный вариант таблицы, в котором главные и побочные подгруппы были преобразованы в отдельные А- и В-группы: главные — в А-группы, побочные — в В-группы. Таких групп оказалось 18. Эта таблица изображена на форзаце учебника.
Существует вариант длиннопериодной таблицы, в которой f-элементы встроены в ряд с d-элементами (рис. 20.2). Существуют и другие варианты изображения периодической системы, их насчитывается около 500.
Рис. 20.2. Длиннопериодная форма периодической системы химических элементов
Периодический закон Дмитрия Ивановича Менделеева
С точки зрения строения атомов периодический закон элементов Менделеева формулируется:
«Свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера)».
Но такая формулировка существовала не всегда. Сам Дмитрий Иванович считал, что периодическая зависимость определяется атомными весами. В современной науке нет понятия атомных весов, но есть определение атомной массы.
На момент создания периодической таблицы было известно 63 химических элементов. Менделеев расположил не только известные ему элементы, но и оставил пустые ячейки. Таким образом, он предсказал открытие новых атомов. На данный момент науке известно 118 элементов. Многие открытые атомы (радиоактивные элементы) не встречаются в естественных условиях, т.к. их создал человек искусственным способом.
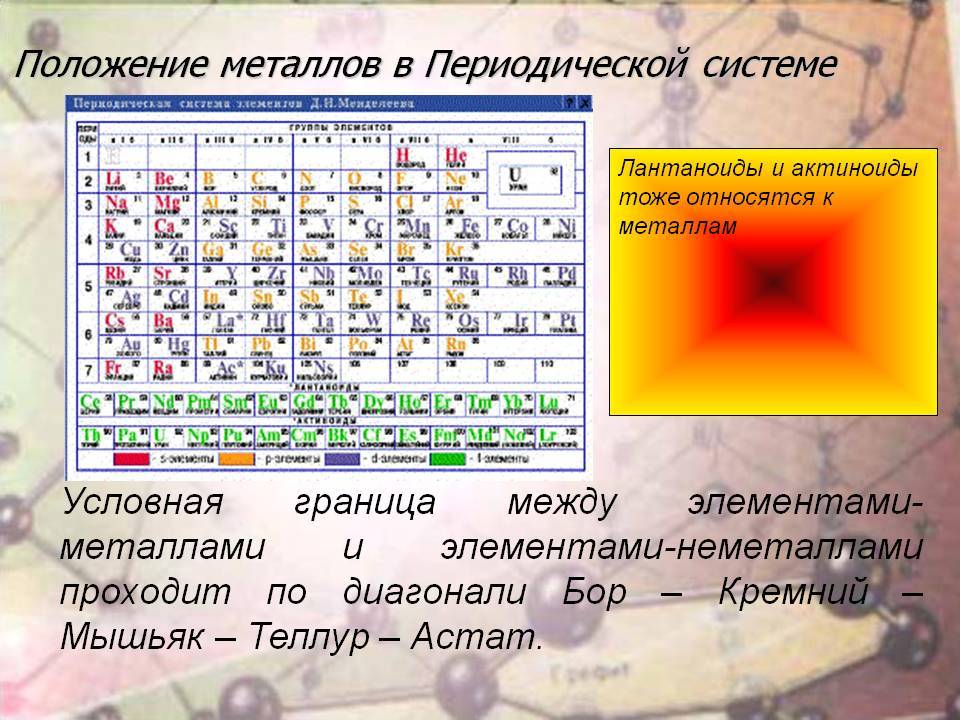
В таблице элементы обозначаются разными цветами. Это сделано не для красоты, а для удобства работы с таблицей. В периодической системе элементы можно распределить на несколько групп.
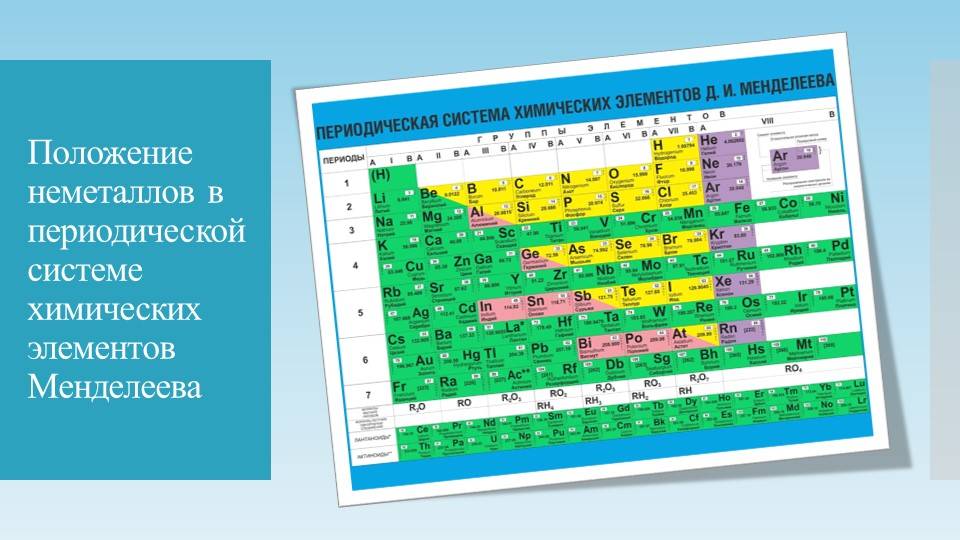
- S-элементы (розовый цвет в периодической таблице) – элементы, у которых последняя заполненная орбиталь –s-оболочка. К ним относятся щелочные и щелочно-земельные металлы. Они являются сильными восстановителями. Они легко отдают свои электроны, т.к. до завершения энергетического уровня им далеко. S-элементы – это супермены, которые делятся со всеми своими электронами.
- Р-элементы (желтый цвет) – элементы, у которых неспаренные электроны в ячейках с наивысшей энергией занимают р-орбиталь. К ним относятся неметаллы, полуметаллы, металлы.
- D-элементы (синий цвет) – элементы, у которых валентные электроны с наивысшей энергией занимают d-орбиталь. Они называются переходными металлами.
- F-элементы (зеленый цвет) – элементы, у которых валентные электроны с наивысшей энергией занимают f-орбиталь. Они занимают особенное место в таблице Д.И. Менделеева. F-элементы вынесены за пределы таблицы и располагаются в низу. Элементы, у которых электроны находятся на 4f-обритали – лантаноиды, а на 5f – актиноиды.
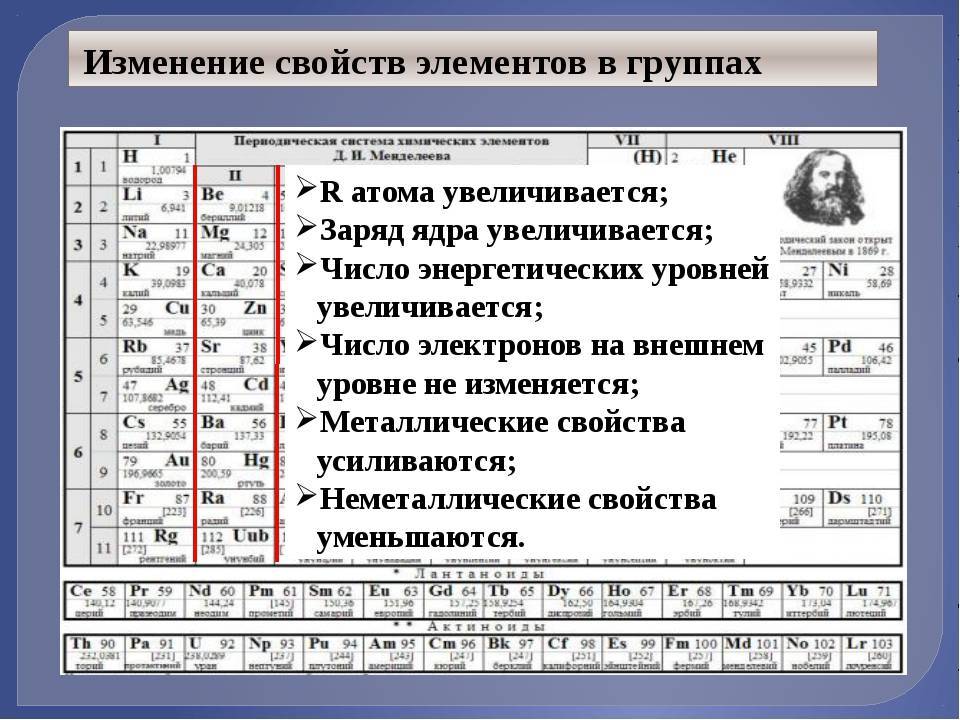
Свойства групп элементов схожи. Он закономерно изменяются в пределах групп и периодов.

Примечания и ссылки
- Иногда они написаны лантаноиды в связи с ИЮПАК по рекомендации для вызова этих элементов лантаноиды на английском языке для того , чтобы избежать путаницы с минеральными анионами , которые на английском языке имеют суффикс -ide : фторид для ионов фторида F – , хлорид для ионов хлора Cl – , галогенид для галогенида , сульфида для сульфида и т. д. В английском языке эта рекомендация мало соблюдается, во французском она тем более, тем более что в нашем языке не существует путаницы с минеральными анионами.
- (in) , раздел 1: Основные константы, единицы и коэффициенты преобразования , подраздел: Электронная конфигурация нейтральных атомов в основном состоянии , 84- е онлайн-издание, CRC Press, Бока-Ратон, Флорида, 2003.
- (in) Родерик П. Макдональд , Использование фильтра из оксида гольмия в спектрофотометрии , Clinical Chemistry , Vol. 10, декабрь 1964, стр. 1117-1120
- (in) Альберт К. Левин и Фрэнк С. Палилла , Новый высокоэффективный катодолюминесцентный люминофор с красным светом (YVO 4: Eu) для цветного телевидения » , Applied Physics Letters , vol. 5, п о 6,15 сентября 1964 г., стр. 118-120
- (in) Мэтью Р. Макдональд, Джефферсон Э. Бейтс, Джозеф В. Циллер, Филипп Фурче и Уильям Дж. Эванс , Завершение серии двух ионов лантаноидов для элементов: синтез молекулярных комплексов Pr 2+ , Gd2 +., Tb 2+ и Lu 2+ » , Журнал Американского химического общества , т. 135, п о 26,3 июля 2013 г., стр. 9857-9868
Области применения лантана
Несмотря на то что, металлы группы лантаноидов очень малочисленно в земной коре, их используют в промышленности достаточно широко.
Из материалов, содержащих лантан, изготовляют колесики чрезвычайно популярных и востребованных зажигалок.

Так, оксид лантана применяют для изготовления оптических стекол (так называемого лантанового стекла). Линзы, призмы, изготовленные с применением этого металла, используются в фото- и киноаппаратуре, в астрономической оптике.
Хромит лантана, который легирован магнием, стронцием или кальцием применяется в изготовлении надежных и высокотемпературных нагревателей, способных работать с температурой до 1780 градусов Цельсия в кислородной атмосфере. С возрастанием температуры сопротивление хромита лантана уменьшается. Коэффициент термического расширения химического элемента лантана достаточно низкий, вследствие этого электронагреватели отличаются значительной долговечностью.
Оксиды лантана используются в синтезировании сверхпроводников, которые предназначены для работы в условиях высоких температур.
Нашел свое применение химический элемент лантан в изготовлении специальных стекол, предназначенных для остекления помещений. Такие полотна, в структуру которых входят соединения лантана, имеют уникальные свойства, они способны снижать температуру в помещениях до 7 градусов.
Лантано-никелевые сплавы (гидриды) широко используются в качестве аккумуляторов водорода. Они представляют собой емкие и надежные хранилища. Для них открыта перспектива быть широко примененными в автомобилестроении, в качестве емкостей для хранения альтернативного топлива.
В электронике лантан используется в качестве проводника. Гексаборид лантана нашел свою применение в электронных микроскопах, это позволило значительно повысить разрешающую способность электронных микроскопных систем, повысить их ресурс.
В качестве еще одной перспективы применения химического элемента лантана современные исследователи видят его в качестве основной составляющей аккумуляторов нового типа с твердым электролитом. Эксперименты показывают, что такие источники обладают высокой удельной электроемкостью. У них длительный срок сохранения энергии без потерь. Отличаются прочностью и долговечностью. Вследствие чего они, возможно, в недалеком будущем составят серьезную конкуренцию другим аккумуляторам.
В медицине препараты, содержащие лантан, нашли применение при гиперфосфатемии. Их назначают в качестве лекарственного средства, который препятствует всасыванию фосфатов при приеме пищи.
Лайфхак: как выучить таблицу химических элементов
Существует один весьма распространённый и устойчивый миф о том, что Дмитрий Менделеев открыл свою таблицу химических элементов во сне.
Друзья мои! Нужно быть совершенно недалёкого представления об учёных, чтобы утверждать о том, что научные открытия можно делать во сне или случайно. Известно высказывание самого Дмитрия Ивановича: «Я над ней (таблицей элементов — прим. Учёного Кота), может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово».
А пытались-то многие!
Попытки классифицировать и систематизировать химические элементы возникали задолго до Менделеева. Первую значимую попытку в 1829 году сделал немецкий химик Иоганн Вольфганг Дёберейнер, затем его труды развил другой немец — Леопольд Гмелин. Во Франции определённых успехов достиг химик-геолог Александр де Шанкуртуа. Однако все эти работы не выдерживали научной критики, как например, не смогла устоять система элементов, предложенная англичанином Джоном Ньюлендсом.
Лишь в 1869 году на заседании Русского химического комитета было заслушано сообщение Дмитрия Менделеева об открытии им фундаментального закона природы — Периодического закона. В том же году вышел его учебник «Основы химии», в котором впервые этот закон был представлен в виде таблицы.
Конечно же и труды Меделеева подверглись жесточайшей научной критике! Его идеи не сразу признавались научным сообществом. Лишь только после того, как были открыты новые химические элементы, предсказанные ранее Менделеевым, например, галлий, скандий, германий, Периодический закон был окончательно признан, как одна из теоретических основ химии.
Первый способ: «раскраска»
Так как легко и просто выучить периодическую таблицу химических элементов Менделеева?
Первым способом можно начать знакомство с периодической таблицей ещё в детстве. Подберите карандаши соответствующего цвета, наклейте наклеечки с названиями элементов и дайте ребёнку раскрашивать таблицу.
Второй способ: «Морской бой»
Второй способ более интересней. Многие наверняка знакомы с игрой «Морской бой». Распечатайте таблицу и обозначьте цифрами и буквами вертикали и горизонтали. «Морской бой» начинается!
Со временем можно усложнять игру — например, перестать нумеровать столбцы и строки. И играть, называя только названия:
- Селен!
- Ранил…
- Теллур!
- Ранил…
- Полоний!
- Убил.
Если идти по дальнейшему пути усложнения игры, то вместо названия химических элементов, можно называть его атомную или молекулярную массу.
Попробуйте! Вы будете лучше ориентироваться в таблице!