Как был открыт
Бокситы и глинозем известны людям веками. С алюминием как металлом они познакомились только к середине XIX века.
Мировой опыт
История открытия – это опыты ученых-одиночек:
- Первую попытку предпринял Парацельс (XVI век). Он выделил из квасцов «квасцовую землю», содержащую оксид неизвестного металла (алюминия).
- Два века спустя процесс повторил немецкий химик Андреас Маргграф. Тоже получил оксид металла, которому присвоил название alumina («вяжущий»).
- Первые миллиграммы металла выделил датчанин Ганс Эрстед. Физик-практик выбрал исходником хлорид алюминия. Нагревая и воздействуя калийной амальгамой, получил чистый металл.
- Чистый калий, а не амальгаму использовал Фридрих Велер. Восстановив металл (получилось несколько крупинок), описал его свойства.
- Еще дальше пошел француз Сент-Клер Девиль. Он изготовил слиток металла, использовав метод Велера. Но вместо калия взял натрий. Девиль предъявил слиток публике на Всемирной выставке в Париже (1855 год), сотворив сенсацию. Спустя год получил металл методом электролиза. Такой успех объясним: ученого спонсировал сам Наполеон III, рассчитывавший приспособить металл для военных нужд.
Получение металла промышленными партиями – заслуга американца Чарльза Холла и француза Поля Эру. Независимо друг от друга они к 1886 году разработали методику расплава глинозема в криолите электролизом.
Металл в России
С глиноземом экспериментировали и русские ученые. Метод, предложенный К.И.Байером, стал классическим для алюминиевой промышленности мира.
Первый алюминиевый завод – Волховский – ввели в строй во времена СССР (1932 год).
Производство сырья исчислялось тысячами тонн. Эта отрасль была на особом счету: ее продукт обеспечивал обороноспособность государства.
Новое «золото»
Первый алюминий был дороже золота:
- Европейская знать использовала алюминиевые столовые приборы (гостям попроще выдавались серебряные или золотые). Моду задал своим указом император Франции Наполеон III.
- Ювелиры изготавливали украшения класса люкс.
- Бесценный подарок сделали англичане русскому гению Дмитрию Менделееву – весы с чашами из золота и алюминия.
Дешевый метод появился к началу ХХ века. В 1911 году во французском Дюрене выпустили первую партию металла. Его назвали в честь этого города. А алюминий перешел в разряд бижутерии.
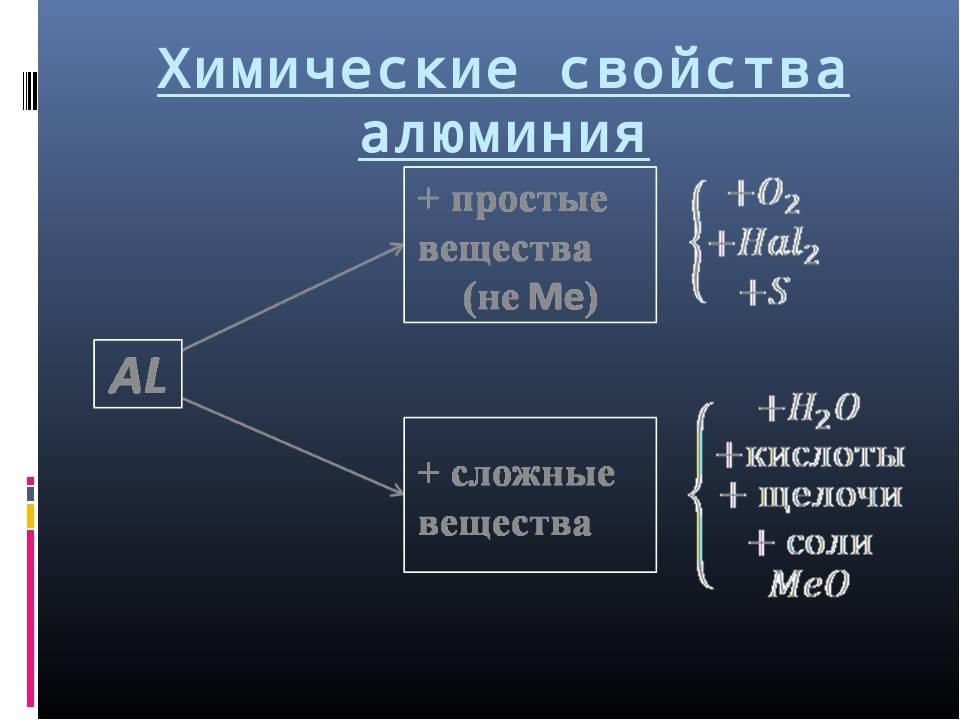
Химические свойства
Являясь довольно химически активным металлом, алюминий активно сопротивляется коррозии. Это происходит благодаря образованию на его внешней поверхности очень прочной оксидной пленки под действием кислорода.
Прочная пленка оксида хорошо защищает поверхность даже от таких сильных кислот, как азотная и серная. Это качество нашло распространение в химии и промышленности для транспортировки концентрированной азотной кислоты.
Химические свойства алюминия
Разрушить пленку можно сильно разбавленной азотной кислотой, щелочами при нагреве или при контакте с ртутью, когда на поверхности образуется амальгама. В перечисленных случаях оксидная пленка не является защитным фактором и алюминий активно взаимодействует с кислотами, щелочами и окислителями. Оксидная пленка также легко разрушается в присутствии галогенов (хлор, бром). Таким образом, соляная кислота HCl, хорошо взаимодействует с алюминием при любых условиях.
Химические свойства алюминия зависят от чистоты металла. Использование состава легирующих присадок некоторых металлов, в частности марганца, позволяет увеличить прочность защитной пленки, повысив, таким образом, коррозионную устойчивость алюминия. Некоторые металлы, к примеру, никель и железо, способствуют снижению коррозионную стойкость, но повышают жароустойчивость сплавов.
Оксидная пленка на поверхности алюминиевых изделий играет отрицательную роль при проведении сварочных работ. Мгновенное окисление ванны расплавленного металла при сварке не позволяет сформировать сварочный шов, поскольку окись алюминия имеет очень высокую температуру плавления. Для сварки алюминия используют специальные сварочные аппараты с неплавящимся электродом (вольфрам). Сам процесс ведется в среде инертного газа – аргона. При отсутствии процесса окисления сварочный шов получается прочным, монолитным. Некоторые легирующие добавки в сплавы дополнительно улучшают сварочные свойства алюминия.
Чистый алюминий практически не образует ядовитых соединений, поэтому активно используется в пищевой промышленности при производстве кухонной посуды, упаковки пищевых продуктов, тары для напитков. Оказывать негативное действие могут лишь некоторые неорганические соединения. Исследованиями также установлено, что алюминий не используется в метаболизме живых существ, его роль в жизнедеятельности ничтожна.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Алюминий — амфотерный металл. Электронная конфигурация атома алюминия 1s 2 2s 2 2p 6 3s 2 3p 1 . Таким образом, на внешнем электронном слое у него находятся три валентных электрона: 2 — на 3s- и 1 — на 3p-подуровне. В связи с таким строением для него характерны реакции, в результате которых атом алюминия теряет три электрона с внешнего уровня и приобретает степень окисления +3. Алюминий является высокоактивным металлом и проявляет очень сильные восстановительные свойства.
[править] Физические свойства
Физические свойства алюминия
Алюминий — серебристо-белый легкий металл, хороший проводник тепла и электричества, пластичен, легко поддается механической обработке.
Кристаллическая структура и атомный радиус
Алюминий имеет кубическую гранецентрированную кристаллическую решетку (пространственная группа Fm3m). Ближайшее расстояние между двумя атомами составляет 2,863Å. Период кристаллической решетки алюминия a = 4,0414 Å при комнатной температуре. Кристаллическая решетка стабильна при температурах от 4К и до температуры плавления 933К. Параметр решетки очень слабо меняется от наличия примесей.
Атомный радиус алюминия определяется как половина расстояния между ближайшими атомами-соседями в кристаллической структуре и равен 1,43Å. В кристаллической структуре алюминия металлическая связь.
Плотность
Теоретическая плотность алюминия рассчитана по параметрам его кристаллической решетки составляет 2,69872 г / см³. Экспериментальные данные плотности для поликристаллического алюминия 99,996 % чистоты составляют 2,6989 (20 °C) г / см, а для монокристаллов — на 0,34 % выше.
Так, плотность расплавленного алюминия чистотой 99,996 % на 6,6 % меньше, чем у твердого металла, и при температуре 973 К составляет 2357 кг / м³ и почти линейно снижается до 2304 кг / м³ при температуре 1173 К.
Термическое расширение
Коэффициент термического расширения α отожженного алюминия чистотой 99,99 % при температуре 293 К составляет 23 · 10−6 и практически линейно возрастает до 37,3 · 10−6 К−1 при температуре 900 К.
Теплопроводность Теплопроводность полностью отожженного алюминия в твердом состоянии снижается с ростом температуры от 2,37 (298 К) до 2,08 Вт · см−1 · К−1 (933,5 К) и при температурах выше 100 К она малочувствительна к чистоте металла.
При нагревании алюминия и переходе его из твердого состояния в жидкое у него резко уменьшается теплопроводность: с 2,08 до 0,907 Вт · см−1 · К−1, а дальше с ростом температуры она увеличивается и при температуре 1000 ° C составляет уже 1, 01 Вт · см−1 · К−1.
Электропроводность
Удельное сопротивление алюминия высокой чистоты (99,99 %) при температуре 20 °C составляет 2,6548 · 10−8. Проводимость алюминия сильно зависит от его чистоты, причем влияние различных примесей зависит не только от концентрации этой примеси, но и от того она находится в твердом растворе или вне его. Наиболее сильно повышают сопротивление алюминия примеси хрома, лития, марганца, магния, титана и ванадия. Удельное сопротивление ρ (мкОм · м) отожженной алюминиевой проволоки в зависимости от содержания примесей (%) можно приблизительно определить по следующей формуле:
ρ = 0,0264 + 0,007Si + 0,0007Fe + 0,04 (Ti + V + Cr + Mn)
При температуре 1,175 ± 0,001 К алюминий переходит в сверхпроводящее состояние.
Удельное сопротивление алюминия при переходе из твердого состояния в жидкое скачком возрастает с 11 до 24 мкОм · см.
Плавление и кристаллизация
Температура плавления алюминия очень чувствительна к чистоте металла и для высокочистого алюминия (99,996 %) составляет 933,4 К (660,3 °C), а температура начала кристаллизации алюминия по Шкале температур Кельвина (1968 г.) считается равной 660,37 °C и используется на протяжении десятков лет для калибровки термопар. Повышение внешнего давления увеличивает температуру плавления алюминия, и она достигает 700 °C при давлении около 100 МПа.
Температура кипения алюминия составляет примерно 2452 ° C, скрытая теплота плавления чистого алюминия — 397 Дж · ч−1, а скрытая теплота испарения 9462 Дж · ч−1.
Удельная теплоемкость Ср алюминия при 0 °C составляет 0,90 Дж · ч−1 · К−1, с увеличением температуры вони растет и определяется уравнением:
Ср = С0 + bT,
где С — теплоемкость при температуре 0 °C; b = 2,96 · 10−3; T — температура (в К).
Поверхностное натяжение
Поверхностное натяжение σ имеет максимальное значение при температуре плавления и с ростом температуры он снижается:
σ = 868 — 0,152 (t — tп),
где σ — поверхностное натяжение, Н / м; t — температура, ° C; tп — температура плавления алюминия, °C.
Вязкость
Вязкость алюминия при температуре плавления составляет 0,012 Па · с и увеличивается при наличии даже небольшого содержания твердых включений, например, оксида алюминия и нерастворимых примесей. С ростом температуры вязкость снижается. Легирующие добавки Ti, Fe, Cu увеличивают, а Si и Mg снижают вязкость сплава.
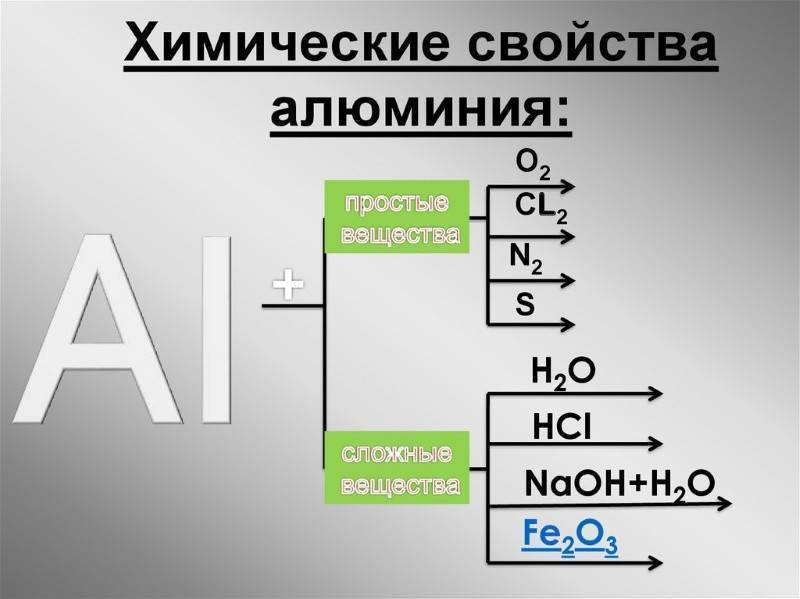
[править] Химические свойства
Алюминий — химически активный элемент. В электрохимическом ряду напряжений он стоит рядом с щелочными и щелочноземельными элементами. Его стандартный электродный потенциал равен −1,67 В.
При обычных условиях алюминий легко взаимодействует с кислородом воздуха и покрывается тонкой (2 · 10 −5 см), но прочной оксидной пленкой Al2О3 (пассивация), которая защищает его от дальнейшего окисления, обуславливая этим высокую коррозионную стойкость, придает ему матового вида и сероватого цвета. Однако при содержании в алюминия или окружающей среде ртути, натрия, магния, кальция, кремния, меди и других элементов прочность оксидной пленки и ее защитные свойства резко снижаются.
При 25 °C алюминий реагирует с хлором, бромом, йодом образуя соответственно хлорид алюминия, бромид алюминия, йодид алюминия, при 600 °C — с фтором, образуя фторид алюминия.
Порошкообразный алюминий при температуре выше 800 °C образует с азотом нитрид алюминия. При взаимодействии атомарного водорода с парами алюминия при −196 °C образуется гидрид (AlH) x (x = 1, 2). Выше 200 °C алюминий реагирует с серой, образуя сульфид алюминия. С фосфором при 500 ° C образует фосфид AlP. При 1200 °C алюминий реагирует с углеродом, образуя карбид алюминия. В присутствии расплавленных солей (криолит и др.) эта реакция протекает при меньшей температуре — 1000 °C
Выше 800 °C могут образоваться соединения одновалентного алюминия, например
\mathrm{Al_2X_3 + 4\ Al \rightarrow 3\ Al_2X \;\;(X \in \{O, S, Se\})}
С рядом металлов и неметаллов алюминий образует сплавы, в которых содержатся интерметаллические соединения — алюминиды, обычно достаточно тугоплавкие и обладают высокой твердостью и жаростойкостью.
Благодаря образованию оксидной пленки алюминий довольно устойчив не только в отношении воздуха, но и воды . С водой алюминий не взаимодействует даже при нагревании. Но когда оксидную пленку разрушить, алюминий энергично взаимодействует с водой, вытесняя водород :
\mathrm{2\ Al + 6\ H_2O \rightarrow 2\ Al(OH)_3 + 3\ H_2\uparrow \;}
Алюминий обладает амфотерными свойствами, он реагирует с кислотами и щелочами .
Он легко взаимодействует с разбавленными азотной и серной кислотами:
- \mathrm{2\ Al + 6\ HNO_3 \rightarrow Al(NO_3)_3 + 3\ NO_2\uparrow + 3H_2O}
- \mathrm{2\ Al + 3\ H_2SO_4 \rightarrow Al_2(SO_4)_3 + 3\ H_2\uparrow}
Очень разбавленные, а также очень крепкие HNO 3 и H 2 SO 4 на алюминий почти не действуют. В отношении ортофосфорной и уксусной кислот алюминий устойчив. Чистый металл также устойчив к соляной кислотакислоте, но обычный технический в ней растворяется.
В растворах сильных щелочей (NaOH, KOH) алюминий растворяется с выделением водорода и образованием алюминатов:
\mathrm{2\ Al + 2\ NaOH + 6\ H_2O \rightarrow 2\ Na + 3\ H_2\uparrow}
Достаточно энергично он разъедается также раствором NH4OH.
Предостережение
Алюминий не заложен изначально в биологические организмы. Но человек получает его микродозы ежедневно – с пищей.
Им богаты горох, пшеница, рис, овсяный «геркулес». Доказана польза алюминия как стимулятора регенерации, развития тканей, работы ЖКТ, ферментов.
По стандартам РФ, в литре питьевой воды не должно быть более 0,2 мг алюминия.
Алюминиевой посудой пользоваться можно, но ограниченно. Безопасны готовка, подогрев, хранение продуктов с нейтральными характеристиками. Приготовление кислых блюд (щи, томат, компот) опасно. Алюминий поступит в еду, создавая избыточную дозу при попадании в организм, плюс «железный» привкус.
Ваша оценка?
Мне нравится1Не нравится
СТРУКТУРА
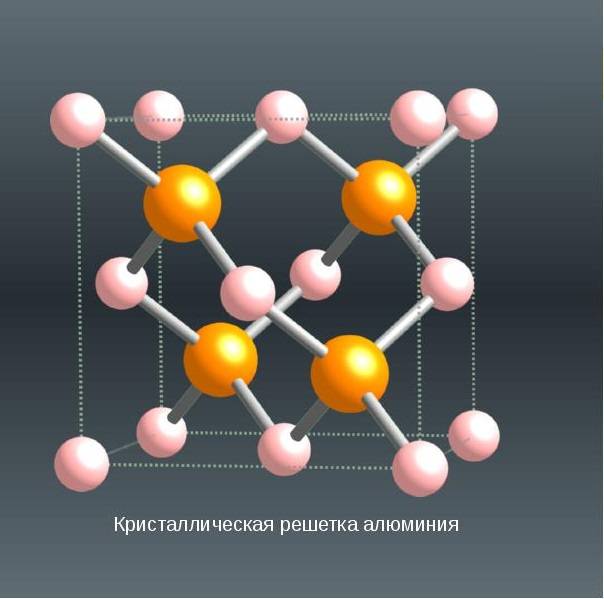
Кубическая гранецентрированная структура. 4 оранжевых атома
Кристаллическая решетка алюминия — гранецентрированный куб, которая устойчива при температуре от 4°К до точки плавления. В алюминии нет аллотропических превращений, т.е. его строение постоянно. Элементарная ячейка состоит из четырех атомов размером 4,049596×10-10 м; при 25 °С атомный диаметр (кратчайшее расстояние между атомами в решетке) составляет 2,86×10-10 м, а атомный объем 9,999×10-6 м3/г-атом.
Примеси в алюминии незначительно влияют на величину параметра решетки. Алюминий обладает большой химической активностью, энергия образования его соединений с кислородом, серой и углеродом весьма велика. В ряду напряжений он находится среди наиболее электроотрицательных элементов, и его нормальный электродный потенциал равен -1,67 В. В обычных условиях, взаимодействуя с кислородом воздуха, алюминий покрыт тонкой (2-10-5 см), но прочной пленкой оксида алюминия А1203, которая защищает от дальнейшего окисления, что обусловливает его высокую коррозионную стойкость. Однако при наличии в алюминии или окружающей среде Hg, Na, Mg, Ca, Si, Си и некоторых других элементов прочность оксидной пленки и ее защитные свойства резко снижаются.
Особенности этого способа
Применяемые растворы содержат от четырех до десяти процентов натра. Температура при травлении щелочью составляет примерно 40-90 градусов по Цельсию.
При необходимости, чтобы получить легкое пенистое покрытие на заготовке, применяется увлажняющее средство или специальная добавка.
Средняя температура в разгаре процесса – шестьдесят градусов. Именно при таких тепловых показателях происходит качественная очистка поверхности.
Оптимальные показатели чистоты алюминия — 99.5%, а концентрация раствора едкого натра — 10, 15, или 20% .
Таким образом, во время реакции алюминий растворяется в едком натре, при этом выделяется водород. В результате формируется составной алюминат, и существует он только в растворе щелочи.
Важнейшие соединения:
Оксид алюминия,
Al2O3: твердое, тугоплавкое вещество белого цвета. Кристаллический Al2O3 химически пассивен, аморфный – более активен. Медленно реагирует с кислотами и щелочами в растворе, проявляя амфотерные свойства:
Al2O3 + 6НСl(конц.) = 2АlСl3 + ЗН2О
Al2O3 + 2NаОН(конц.) + 3Н2О = 2Na[Al(OH)4] (в расплаве щелочи образуется NaAlO2).Гидроксид алюминия, Al(OH)3: белый аморфный (гелеобразный) или кристаллический. Практически не растворим в воде. При нагревании ступенчато разлагается. Проявляет амфотерные, равно выраженные кислотные и основные свойства.
При сплавлении с NaOH образуется NaAlO2. Для получения осадка Аl(ОН)3 щелочь обычно не используют (из-за легкости перехода осадка в раствор), а действуют на соли алюминия раствором аммиака – при комнатной температуре образуется Аl(ОН)3Соли алюминия. Соли алюминия и сильных кислот хорошо растворимы в воде и подвергаются в значительной степени гидролизу по катиону, создавая сильнокислотную среду, в которой растворяются такие металлы, как магний и цинк:
Al3+ + H2O =AlOH2+ + H+
Нерастворимы в воде фторид AlF3 и ортофосфат АlРO4, а соли очень слабых кислот, например Н2СО3, вообще не образуются осаждением из водного раствора.
Известны двойные соли алюминия – квасцы состава MAl(SO4)2*12H2O (M=Na+, K+, Rb+, Cs+, ТI+, NH4+), самые распространенные из них алюмокалиевые квасцы KAl(SO4)2*12Н2O.
Растворение амфотерных гидроксидов в щелочных растворах рассматривается как процесс образования гидроксосолей (гидроксокомплексов). Экспериментально доказано существование гидроксомплексов [Аl(ОН)4(Н2О)2] -, [Аl(ОН)6]3-, [Аl(ОН)5(Н2O)]2-; из них первый – наиболее прочный. Координационное число алюминия в этих комплексах равно 6, т.е. алюминий является шестикоординированным.Бинарные соединения алюминия
Соединения с преимущественно ковалентными связями, например сульфид Al2S3 и карбид Аl4С3 полностью разлагаются водой:
Al2S3 + 6Н2О = 2Аl(ОН)3 + 3Н2S Аl4С3 + 12H2O = 4Аl(ОН)3 + 3СН4
Свойства
Физические свойства алюминия позволяют легко вытягивать заготовки этого металла в проволоку и прокатывать в тонкие листы. Этот металл не является прочным, для повышения данного показателя при выплавке его легируют различными добавками: медью, кремнием, магнием, марганцем, цинком
Для промышленного назначения важно еще одно физическое свойство вещества алюминия – это его способность быстро окисляться на воздухе. Поверхность изделия из алюминия в естественных условиях обычно покрыта тонкой оксидной пленкой, которая эффективно защищает металл и препятствует его коррозии. При уничтожении этой пленки серебристый металл быстро окисляется, при этом его температура заметно повышается
При уничтожении этой пленки серебристый металл быстро окисляется, при этом его температура заметно повышается.
Уход за алюминиевой посудой
Начать нужно с универсального совета. Посуду лучше мыть сразу после использования. Во-первых, это значительно легче. Во-вторых, так можно продлить срок службы у предмета. Единственная оговорка – необходимо дать время посуде на остывание. Ведь попадание даже капли холодной воды на раскаленный металл способно привести к его деформации.
Удаление жира и гари
Блеск у алюминия возвращается даже после удаления многолетней гари:
Понадобится большая емкость из металла, чтобы в ней полностью утопилась испорченная сковорода или кастрюля.
Тара заполняется водой.
Кусок хозяйственного мыла измельчается на терке.
Порошок добавляется в воду.
Туда же вливается 300 грамм силикатного клея.
Раствор доводится до кипения, и в него погружается грязная посуда.
Необходимо продержать ее на медленном огне не меньше одного часа.
После этого с предосторожностями ее достают из кипятка.
Мягкая фланель легко и быстро убирает размягченную гарь.
После завершения чистящей операции следует тщательно прополоскать изделие. Таким же способом удаляется и накипь с поверхности. Но можно попробовать приготовить раствор из нашатырного спирта (10 капель на литр) и мыла. Технология очистки такая же.

Удаление нагара с алюминиевой сковородыИсточник sdelai-lestnicu.ru
Возвращение блеска
Сделать алюминиевые предметы, как новыми, помогут следующие действия:
- Внутрь посуды нужно залить кислое молоко и оставить на 40 минут.
- Натереть стенки половинкой кислого яблока или лимона. Оставить посуду на пару часов.
- Замочить предмет в пищевом уксусе на несколько часов.
- Прокипятить 10 минут в посуде порезанную луковицу.
- Натереть мокрую поверхность зубным порошком и оставить на всю ночь.
После выполнения любой из операций всегда необходимо заканчивать тщательным полосканием в теплой воде.
Борьба с чернотой
Вернуть блеск алюминию после его закопчения на костре может винный уксус или лимонная кислота:
- Салфетка смачивается данными растворами. Затем ей протираются стенки.
- Внутрь посуды наливается вода. В нее добавляется или уксус, или кислота.
- Жидкость доводится до кипения. Огонь убавляется до минимума и выжидается не более 15 минут.
- После остывания, раствор сливается.
- Стенки проходят мягкой губкой с теплой водой.
Обычно в походе для чистки используют песок для очистки котелка от копоти костра. Не нужно этого делать. Причины будут указаны ниже. Лучше принести закопченную посуду домой и воспользоваться вышеуказанным рецептом.
Предостережения
Все жесткие виды чистящих средств под строгим запретом. Даже если не прикладывать значительных усилий, поверхность все равно поцарапается. Нарушение защитной пленки приведет к тому, что алюминий будет контактировать с пищей.

Мытье посуды жесткой мочалкойИсточник biolshop.com.ua
Вторая причина исключения жестких средств для чистки заключается в том, что сталь способна оставлять глубокие борозды. Они со временем забиваются грязью. Удалить ее из глубокой царапины не представляется возможным. По этой же причине лучше не использовать песок или любые абразивы.
Еще под запретом сода. Хоть она и считается универсальным чистящим средством, но для алюминия категорически не подходит. Ведь в ней находятся щелочи, а они будут губительны для наружного защитного слоя.
Нельзя мыть предметы в посудомоечной машине. Во-первых, из-за этого блеск алюминий потеряет. Во-вторых, моющие средства для этих агрегатов все без исключения содержат щелочь. Производители даже специально увеличивают их количество для увеличения качества мытья. Посуда будет безнадежно испорчена.
Виды и свойства алюминиевых сплавов
Алюминиево-магниевые сплавы
Эти пластичные сплавы обладают хорошей свариваемостью, коррозийной стойкостью и высоким уровнем усталостной прочности.
В алюминиево-магниевых сплавах содержится до 6% магния. Чем выше его содержание, тем прочнее сплав. Повышение концентрации магния на каждый процент увеличивает предел прочности примерно на 30 МПа, а предел текучести — примерно на 20 МПа. При подобных условиях уменьшается относительное удлинение, но незначительно, оставаясь в пределах 30–35%. Однако при содержании магния свыше 6% механическая структура сплава в нагартованном состоянии приобретает нестабильных характер, ухудшается коррозийная стойкость.
Для улучшения прочности в сплавы добавляют хром, марганец, титан, кремний или ванадий. Примеси меди и железа, напротив, негативно влияют на сплавы этого вида — снижают свариваемость и коррозионную стойкость.
Алюминиево-марганцевые сплавы
Это прочные и пластичные сплавы, которые обладают высоким уровнем коррозионной стойкости и хорошей свариваемостью.
Для получения мелкозернистой структуры сплавы этого вида легируют титаном, а для сохранения стабильности в нагартованном состоянии добавляют марганец. Основные примеси в сплавах вида Al-Mn — железо и кремний.
Сплавы алюминий-медь-кремний
Сплавы этого вида также называют алькусинами. Из-за высоких технических свойств их используют во втулочных подшипниках, а также при изготовлении блоков цилиндров. Обладают высокой твердостью поверхности, поэтому плохо прирабатываются.
Алюминиево-медные сплавы
Механические свойства сплавов этого вида в термоупрочненном состоянии порой превышают даже механические свойства некоторых низкоуглеродистых сталей. Их главный недостаток — невысокая коррозионная стойкость, потому эти сплавы обрабатывают поверхностными защитными покрытиями.
Алюминиево-медные сплавы легируют марганцем, кремнием, железом и магнием. Последний оказывает наибольшее влияние на свойства сплава: легирование магнием значительно повышает предел текучести и прочности. Добавление железа и никеля в сплав повышает его жаропрочность, кремния — способность к искусственному старению.
Алюминий-кремниевые сплавы
Сплавы этого вида иначе называют силуминами. Некоторые из них модифицируют добавками натрия или лития: наличие буквально 0,05% лития или 0,1% натрия увеличивает содержание кремния в эвтектическом сплаве с 12% до 14%. Сплавы применяются для декоративного литья, изготовления корпусов механизмов и элементов бытовых приборов, поскольку обладают хорошими литейными свойствами.
Сплавы алюминий-цинк-магний
Прочные и хорошо обрабатываемые. Типичный пример высокопрочного сплава этого вида — В95. Подобная прочность объясняется высокой растворимостью цинка и магния при температуре плавления до 70% и до 17,4% соответственно. При охлаждении растворимость элементов заметно снижается.
Основной недостаток этих сплавов — низкую коррозионную стойкость во время механического напряжения — исправляет легирование медью.
Авиаль
Авиаль — группа сплавов системы алюминий-магний-кремний с незначительными добавлениями иных элементов (Mn, Cr, Cu). Название образовано от сокращения словосочетания «авиационный алюминий».
Применять авиаль стали после открытия Д. Хансоном и М. Гейлером эффекта искусственного состаривания и термического упрочнения этой группы сплавов за счет выделения Mg2Si.
Эти сплавы отличаются высокой пластичностью и удовлетворительной коррозионной стойкостью. Из авиаля изготавливают кованые и штампованные детали сложной формы. Например, лонжероны лопастей винтов вертолетов. Для повышения коррозионной стойкости содержание меди иногда снижают до 0,1%.
Также сплав активно используют для замены нержавеющей стали в корпусах мобильных телефонов.
Как был открыт алюминий и каковы его основные свойства
Алюминий представляет собой парамагнитный металл, достаточно легкий, имеющий серебристый цвет. Он хорошо поддается механической обработке и литью, просто формуется. В земной коре этот элемент третий по распространенности, впереди только кислород и кремний. Наши недра содержат целых 8 % данного металла, что значительно больше золота, количество которого составляет не более пяти миллионных долей процента.

Алюминий активно используется в большинстве сфер производства. Его сплавы применяются для изготовления бытовой техники, транспорта, в машиностроении и электротехнике. Капитальное строительство также не может обойтись без него.
Он чрезвычайно распространен в земной коре, являясь первым из металлов и третьим химическим элементом (первое место у кислорода, второе – у кремния). Доля алюминия в наших недрах – 8,8 %. Металл является частью большого количества горных пород и минералов, основной из которых – алюмосиликат.
В виде соединений алюминий находится в базальтах, полевых шпатах, гранитах, глине и пр. Однако в основном его получают из бокситов, которые достаточно редко встречаются в виде месторождений. В России такие залежи есть только на Урале и в Сибири. В промышленных масштабах алюминий можно также добывать из нефелинов и алунитов.
Рекомендовано к прочтению
- Резка меди лазером: преимущества и недостатки технологии
- Виды резки металла: промышленное применение
- Металлообработка по чертежам: удобно и выгодно
Ткани животных и растений содержат алюминий в виде микроэлемента. Некоторые организмы, например, моллюски и плауны, являются его концентраторами, накапливая в своих органах.
Человечеству с давних времен знакомо соединение алюминия под названием алюмокалиевые квасцы. Применялось оно в процессе выделки кожи, в качестве средства, которое, набухая, связывает различные компоненты смеси. Во второй половине XVIII в. ученые открыли оксид алюминия. А вот вещество в чистом виде получили значительно позже.
Впервые это удалось Ч. К. Эрстеду, который выделил алюминий из хлорида. Проводя опыт, он обрабатывал соли калия амальгамой, в результате чего выделился порошок серого цвета, признанный всеми чистым алюминием.
В дальнейшем, исследуя металл, ученые определили его химические свойства, проявляющиеся в высокой способности к восстановлению и активности. Именно поэтому с алюминием долгое время не работали.
Но уже в 1854 г. французский ученый Девиль, применив электролиз расплава, сумел получить металл в слитках. Данный метод используется и сейчас. В промышленных масштабах алюминий стали производить в начале XX в., когда предприятия смогли получить доступ к большому количеству электроэнергии.

Сегодня алюминий является одним из самых используемых в производстве бытовой техники и строительстве металлом.
https://youtube.com/watch?v=grpYtJU3VU0
https://youtube.com/watch?v=7isFzdC_VHo
Производство и рынок
Основная статья: Алюминиевая промышленность
Производство алюминия в миллионах тонн
Достоверных сведений о получении алюминия до XIX века нет. Встречающееся иногда со ссылкой на «Естественную историю» Плиния утверждение, что алюминий был известен при императоре Тиберии, основано на неверном толковании источника.
В 1825 году датский физик Ганс Христиан Эрстед получил несколько миллиграммов металлического алюминия, а в 1827 году Фридрих Вёлер смог выделить крупинки алюминия, которые, однако, на воздухе немедленно покрывались тончайшей плёнкой оксида алюминия.
До конца XIX века алюминий в промышленных масштабах не производился.
Только в 1854 году Анри Сент-Клер Девиль (его исследования финансировал Наполеон III, рассчитывая, что алюминий пригодится его армии) изобрёл первый способ промышленного производства алюминия, основанный на вытеснении алюминия металлическим натрием из двойного хлорида натрия и алюминия NaCl·AlCl3. В 1855 году был получен первый слиток металла массой 6—8 кг. За 36 лет применения, с 1855 по 1890 год, способом Сент-Клер Девиля было получено 200 тонн металлического алюминия. В 1856 году он же получил алюминий электролизом расплава хлорида натрия-алюминия.
В 1885 году был построен завод по производству алюминия в немецком городе Гмелингеме, работающий по технологии, предложенной Николаем Бекетовым. Технология Бекетова мало чем отличалась от способа Девиля, но была проще и заключалась во взаимодействии между криолитом (Na3AlF6) и магнием. За пять лет на этом заводе было получено около 58 т алюминия — более четверти всего мирового производства металла химическим путём в период с 1854 по 1890 год.
Метод, изобретённый почти одновременно Чарльзом Холлом в США и Полем Эру во Франции (1886 год) и основанный на получении алюминия электролизом глинозёма, растворённого в расплавленном криолите, положил начало современному способу производства алюминия. С тех пор, в связи с улучшением электротехники, производство алюминия совершенствовалось. Заметный вклад в развитие производства глинозёма внесли русские учёные К. И. Байер, Д. А. Пеняков, А. Н. Кузнецов, Е. И. Жуковский, А. А. Яковкин и др.
Первый алюминиевый завод в России был построен в 1932 году в городе Волхов. Металлургическая промышленность СССР в 1939 году производила 47,7 тыс. тонн алюминия, ещё 2,2 тыс. тонн импортировалось.
Вторая мировая война значительно стимулировала производство алюминия. Так, в 1939 году общемировое его производство, без учёта СССР, составляло 620 тыс. т, но уже к 1943 году выросло до 1,9 млн т.
К 1956 году в мире производилось 3,4 млн т первичного алюминия, в 1965 году — 5,4 млн т, в 1980 году — 16,1 млн т, в 1990 году — 18 млн т.
В 2007 году в мире было произведено 38 млн т первичного алюминия, а в 2008 — 39,7 млн т. Лидерами производства являлись:
- КНР (в 2007 году произвёл 12,60 млн т, а в 2008 — 13,50 млн т)
- Россия (3,96/4,20)
- Канада (3,09/3,10)
- США (2,55/2,64)
- Австралия (1,96/1,96)
- Бразилия (1,66/1,66)
- Индия (1,22/1,30)
- Норвегия (1,30/1,10)
- ОАЭ (0,89/0,92)
- Бахрейн (0,87/0,87)
- ЮАР (0,90/0,85)
- Исландия (0,40/0,79)
- Германия (0,55/0,59)
- Венесуэла (0,61/0,55)
- Мозамбик (0,56/0,55)
- Таджикистан (0,42/0,42)
В 2016 году было произведено 59 млн тонн алюминия
См. также: Список стран по выплавке алюминия
На мировом рынке запас составляет 2,224 млн т., а среднесуточное производство — 128,6 тыс. т. (2013.7).
В России монополистом по производству алюминия является компания «Российский алюминий», на которую приходится около 13 % мирового рынка алюминия и 16 % глинозёма.
Мировые запасы бокситов практически безграничны, то есть несоизмеримы с динамикой спроса. Существующие мощности могут производить до 44,3 млн т первичного алюминия в год. Следует также учитывать, что в будущем некоторые из применений алюминия могут быть переориентированы на использование, например, композитных материалов.
Цены на алюминий (на торгах международных сырьевых бирж) с 2007 по 2015 годы составляли в среднем 1253—3291 долларов США за тонну.