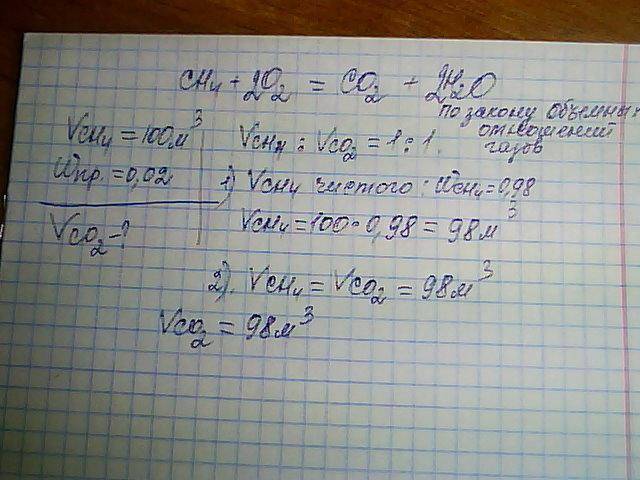Как же определяется молярная масса воздуха?
Все вещества различаются по массе, и этот показатель является очень индивидуальным. Для сложных веществ учитывается число атомов, находящемся в нем. Так чему равна молярная масса воздуха? Это сумма всех массовых долей элементов, которые входят в данное вещество. В данном случае это молярные массы азота, кислорода, аргона, углекислого газа, водорода и других веществ. Из них азот составляет 78% от общего объема, кислород 21%, а остальные же вещества содержатся в гораздо меньшем количестве.
Существует несколько методов проведения измерения:
- Откачка воздуха из колбы позволяет при помощи уравнения состояния газа позволяет также вычислить этот показатель.
- При помощи классического химического уравнения, в котором находятся все молярные массы газов, входящих в состав воздуха.
- Также существуют уже готовые таблицы, со средними значениями.
Если производить расчеты, следуя определению, что объемы газов являются пропорциональными их количествам, то мы можем выражать среднюю массу как через объем, так и через количество. Поэтому молярная масса воздуха в химии рассчитывается по формуле, включающей в себя отношение массы вещества к его количеству. В сложных веществах надо найти отдельно массы каждого вещества, которое входит в состав.
Но этот способ расчетов по большей части затрагивает ситуации, когда воздух находится в своем обычном состоянии. Также можно вычислить и массу в других ситуациях.
Формула, по которой рассчитывается молярная масса влажного воздуха является формулой для смеси газов. При расчетах учитываются доли сухого воздуха и водяного пара, а также соответствующее для них давление и молярные массы. Получается формула выглядит как сумма объема с молярной массой водяного пара и объема с молярной массой сухого воздуха.
Известно, что молярная масса воздуха при нормальных условиях — 29 г/моль. Именно такой показатель принят за средний. Но он может колебаться в зависимости от состава воздуха. Поэтому сильные изменения свидетельствуют о нарушениях баланса газов в воздухе. Так если в воздухе будет содержаться 92% азота, то это будет смертельно опасно для человека. Именно поэтому состав воздуха так важен и необходимо его постоянно контролировать. Сейчас, в результате деятельности человека, наблюдается неблагоприятная экологическая картина и во многом она связана с загрязнением воздуха. Именно выбросы в воздух различных веществ нарушают его естественный состав, что приводит к ухудшению условий жизни. Многие экологические проблемы тоже являются уже следствием загрязнения воздуха. Смог, кислотные дожди и изменение состава всей атмосферы.
Закажите бесплатно консультацию эколога
Молярная масса элементов и соединений
Соединения — вещества, состоящие из различных атомов, которые химически связаны друг с другом. Например, приведенные ниже вещества, которые можно найти на кухне у любой хозяйки, являются химическими соединениями:
- соль (хлорид натрия) NaCl
- сахар (сахароза) C₁₂H₂₂O₁₁
- уксус (раствор уксусной кислоты) CH₃COOH
Молярная масса химических элементов в граммах на моль численно совпадает с массой атомов элемента, выраженных в атомных единицах массы (или дальтонах). Молярная масса соединений равна сумме молярных масс элементов, из которых состоит соединение, с учетом количества атомов в соединении. Например, молярная масса воды (H₂O) приблизительно равна 1 × 2 + 16 = 18 г/моль.
Проверка баллона
После истечения пятилетнего срока баллоны для углекислого газа должны проходить проверку. Без её прохождения дальнейшее использование ёмкости невозможно. Освидетельствование может проводить только уполномоченная организация.
Процедура предусматривает проверку состояния оборудования
При этом обращают внимание на следующее:
- Выполняется тщательный осмотр внешнего вида. Не должно присутствовать повреждений или обширных и глубоких следов ржавчины.
- Производится полное удаление углекислого газа из обследуемой ёмкости. Это делают с использованием инертных газов.
- Проверяется исправность работы вентиля.
- Выполняется оценка толщины стенок баллона. Для этого производится его взвешивание. Результат покажет, насколько уменьшился его вес и, соответственно, истончились стенки.
- Гидравлические испытания показывают исправность работы оборудования.
- После проверки выполняется просушка. Это делают с помощью прогретого воздуха.
- При необходимости может производиться замена вентиля или выполняться покраска резервуара.
После того, как проверка окончена, с помощью специального клейма ставят дату проведения и обводят овальной линией. На баллоне должен присутствовать его технический паспорт. В нём содержится такая информация: заводской номер, вместимость в литрах воды, масса при изготовлении, рабочее и проверочное давление в атмосферах, клеймо завода, проводившего переаттестацию.
Вместимость в литрах воды увеличилась, это говорит о возможности образования внутренних трещин или изменении геометрии ёмкости. Если возрастание превысило 1,5%, то это считается признаком неисправности оборудования.

Баллон с углекислым газом Источник chipmaker.ru
Формула углекислого газа
Двуокись углерода (двуокись углерода, двуокись углерода, моноксид углерода (IV), карбоновый ангидрид, сухой лед) представляет собой бесцветный газ без запаха со слегка кислотным вкусом. Сформировано путем объединения двух элементов: углерода и кислорода.
Химические, структурные и электронные формулы двуокиси углерода
Химическая формула: ( mathrm 2 )
Структурная формула: ( O=C=O )
Химические, структурные и электронные формулы двуокиси углерода
Молярная масса: 44,01 г / моль.
Физические свойства двуокиси углерода
В стандартных условиях — газ без цвета и запаха, с кислым вкусом. При атмосферном давлении в жидком состоянии не существует, а сильное охлаждение кристаллизуется в виде «сухого льда» — белой снежной массы. Температура сублимации составляет -78 ° С. В обычных условиях 0,9 объема двуокиси углерода растворяют в одном объеме воды.
Химические свойства двуокиси углерода
Это оксид кислоты.
При растворении в воде образуется угольная кислота:
( C O_+H_ O leftrightarrow H_ C O_ )
Он взаимодействует с основными оксидами и основаниями с образованием карбонатов и бикарбонатов (соли углекислоты):
( N a_ O+C O_ rightarrow N a_ C O_ )
( 2 K O H+C O_ rightarrow K_ C O_+H_ O )
( mathrm+mathrm_(избыток) rightarrow K H C O_ )
Не поддерживает горение, но при нагревании может окислять активные металлы:
( C O_+2 M g rightarrow 2 M g O+C )
Качественная реакция — мутность извести ( (mathrm(mathrm) 2) ) из-за образования белого осадка карбоната кальция:
( mathrm(mathrm)_+mathrm_ rightarrow mathrm_ downarrow+mathrm_ mathrm )
Углекислый газ образуется гниением и сжиганием органического вещества. Содержится в воздухе и минеральных источниках, высвобождаемых во время дыхания животных и растений.
В промышленности углекислый газ производится термическим разложением карбонатов:
В лаборатории — действием сильных кислот на карбонаты или бикарбонаты:
( mathrm_+2 mathrm rightarrow mathrm_+mathrm_ mathrm+mathrm_ uparrow )
Примеры решения проблем
Рассчитать количество двуокиси углерода ( (mathrm) ), которое может быть получено путем сжигания 12 тонн угля, если выход продукта составляет 90% от теоретически возможного.
Напишите уравнение для реакции горения:
Рассчитайте количество углеродного вещества по формуле:
Согласно уравнению реакции
( n(C)=nleft(C O_right)=1000000 моль )
1 моль газа в нормальных условиях составляет 22,4 литра.
Рассчитайте теоретический объем углекислого газа:
( Vteorleft(C O_right)=1000000 cdot 22,4=2240000=22400м3 )
Мы вычисляем практический объем углекислого газа:
( Vpractleft(C O_right)=22400 cdot 0,9=20160м3 )
Объем производимого диоксида углерода равен 20160 м3.
Рассчитать объем 20% раствора соляной кислоты (плотность = 1,1 г / мл), что необходимо для получения 5,6 литров диоксида углерода из образца известняка, который содержит 5% примесей.
Напишите уравнение реакции:
( mathrm_+2 mathrm rightarrow mathrm_+mathrm_ mathrm+mathrm_ uparrow )
Во время реакции образуется углекислота ( (mathrm 2 mathrm 3) ), которая сразу же разлагается в воду ( (mathrm 2 mathrm) ) и двуокись углерода ( (mathrm 2) ).
Рассчитайте количество вещества диоксида углерода по формуле:
где ( mathrm ) — молярный объем, т. е. объем, который занимает один моль газа в нормальных условиях. ( mathrm=22,4 л/моль )
Для расчета количества вещества соляной кислоты мы составляем пропорцию в соответствии с уравнением реакции:
2 моля ( mathrm ) приводят к образованию 1 моль ( mathrm 2 )
x моль ( mathrm )приводит к образованию 0,25 моль ( mathrm 2 )
Молярная масса соляной кислоты составляет 36,5 г / моль. Рассчитайте массу соляной кислоты:
( m(H C l)=n(H C l) cdot M(H C l)=0,5мольcdot 36,5г/моль=18,25г )
Выражение для массовой доли вещества в растворе:
Рассчитайте массу раствора соляной кислоты по формуле:
Если раствор ( mathrm ) составляет 20%, то массовая доля соляной кислоты в нем будет равна 0,20.
Рассчитайте объем раствора соляной кислоты по формуле:
Объем 20% -ного раствора соляной кислоты составляет 82,95 мл.
Воздействие на человека
Углекислый газ нетоксичен, но при вдыхании его повышенных концентраций в воздухе по воздействию на воздуходышащие живые организмы его относят к удушающим газам. По ГОСТу (ГОСТ 8050-85) углекислота относится к IV классу опасности.
Незначительные повышения концентрации, вплоть до 0,2−0,4 % (2000−4000 ppm), в помещениях приводят к развитию у людей сонливости и слабости.
| Влияние на взрослых здоровых людей | Концентрация углекислого газа, ppm |
|---|---|
| Нормальный уровень на открытом воздухе | 350—450 |
| Приемлемые уровни | <600 |
| Жалобы на несвежий воздух | 600—1000 |
| Максимальный уровень стандартов ASHRAE и OSHA | 1000 |
| Общая вялость | 1000—2500 |
| Возможны нежелательные эффекты на здоровье | 1000—2500 |
| Максимально допустимая концентрация в течение 8 часового рабочего дня | 5000 |
Опасными для здоровья концентрациями считаются концентрации около 7−10%, при которых развиваются симптомы удушья, проявляющиеся в виде головной боли, головокружения, расстройстве слуха и в потере сознания (симптомы, сходные с симптомами высотной болезни), эти симптомы развиваются, в зависимости от концентрации, в течение времени от нескольких минут до одного часа.
Для помещений нормальным является уровень CO₂ около 600 ppm (частей на миллион). Повышенные концентрации углекислого газа снижают когнитивные способности людей. Уже при 1200 ppm расширяются кровеносные сосуды в мозге, снижается активность нейронов и уменьшается объём коммуникации между регионами мозга. В школьных классах типичной является концентрация 2000−2500, а общий разброс значений — от 1000 до 6000, это вызывает обеспокоенность у исследователей, поскольку выявлено снижение результатов учеников, выполняющих тестовые задания в душных помещениях.
При вдыхании воздуха с очень высокими концентрациями газа смерть наступает очень быстро от удушья, вызванного гипоксией.
Несмотря на то, что даже концентрация 5—7% CO₂ в воздухе несмертельна, но при концентрации 0,1 % (такое содержание углекислого газа иногда наблюдается в воздухе мегаполисов), люди начинают чувствовать слабость, сонливость. Это показывает, что даже при высоком уровне кислорода, большая концентрация CO₂ существенно влияет на самочувствие человека.
| Симптомы у взрослых здоровых людей | Концентрация углекислого газа, ppm |
|---|---|
| Легкое отравление, учащается пульс и частота дыхания, тошнота и рвота | 30 000 |
| Добавляется головная боль и легкое нарушение сознания | 50 000 |
| Потеря сознания, в дальнейшем — смерть | 100 000 |
Вдыхание воздуха с повышенной концентрацией этого газа не приводит к долговременным расстройствам здоровья. После удаления пострадавшего из атмосферы с высокой концентрацией углекислого газа быстро наступает полное восстановление здоровья и самочувствия.
При пониженном уровне углекислого газа в крови также возможен обморок. См. Гипервентиляция в статье “Лёгкие человека”.
Углекислый газ: получение в промышленности
Существует большое количество способов промышленного получения углекислоты. Наиболее рентабельными являются варианты добычи газа, основанные на получении СО2, который образовывается на химических производствах в виде отходов.
Газообразный оксид углерода (IV) получают из промышленного дыма способом адсорбции моноэтаноламина. Частицы этого вещества подаются в трубу с отходами и вбирают в себя углекислоту. После прохождение через смесь CO2 моноэтаноламины направляются на очистку в специальные резервуары, в которых, при определённых показателях температуры и давления, происходит высвобождение углекислого газа.
Углекислый газ высокого качества получается в результате брожения сырья при изготовлении спиртных напитков. На таких производствах газообразный СО2 обрабатывают водородом, перманганатом калия и углем. В результате реакции получают жидкую форму углекислоты.
Твёрдое состояние СО2 или «сухой лёд» также получают из отходов пивоваренных заводов и ликероводочных производств. Это агрегатное состояние вещества в промышленных масштабах образуется в такой последовательности:
- Из резервуара, где происходит брожение, газ подаётся в ёмкость для промывки.
- Углекислота направляется в газгольдер, в котором подвергается воздействию повышенного давления.
- В специальных холодильниках СО2 охлаждается до определённой температуры.
- Образовавшаяся жидкость фильтруется через слой угля.
- Углекислота снова направляется в холодильник, где производится дополнительное охлаждение вещества с последующим прессованием.
Таким образом получается высококачественный «сухой лёд», который может использоваться в пищевой промышленности, растениеводстве или в быту.
Химические свойства углекислого газа, реакции с другими веществами
Общие химические свойства углекислого газа: CO2 инертен, то есть химически не активен; при попадании в водный раствор легко вступает в реакции. Большинство кислотных оксидов устойчивы к высоким температурам, но углекислота при их воздействии восстанавливается.
Взаимодействие с другими веществами:
1) Углекислота относится к кислотным оксидам, то есть в сочетании с водой образуется кислота. Однако угольная кислота неустойчива и распадается сразу. Эта реакция имеет обратимый характер:
СО2 + H2O CO2 × H2O (растворение) Н2СО3
Диоксид углерода + вода угольная кислота
Молекула угольной кислоты
2) При взаимодействии углекислого газа и соединений азота с водородом (аммиаком) в водном растворе происходит разложение до углеаммонийной соли.
2NH3 + CO2 + H2O = NH4HCO3
Аммиак + углекислота = гидрокарбонат аммония
Полученное вещество часто используется в приготовлении хлеба и различных кондитерских изделий.
3) Ход некоторых реакций должен поддерживаться высокими температурами. Примером является производство мочевины при 130 °C и давлении 200 атм., схематически изображаемое так:
2NH3 + СО2 → (NH2)2СО + H2O
Аммиак + диоксид углерода → карбамид + вода
Также под воздействием температуры около 800 градусов протекает реакция образования оксида цинка:
Zn + CO2 → ZnO + CO
Цинк + двуокись углерода → оксид цинка + оксид углерода
4) Возможно уравнение с гидроксидом бария, при котором выделяется средняя соль.
Ba(OH)2+CO2 = BaCO3 + H2O
Гидроксид бария + углекислота = карбонат бария + оксид водорода.
Применяется для регулировки калориметров по теплоемкости. Также вещество используют в промышленности для производства красных кирпичей, синтетических тканей, фейерверков, гончарных изделий, плитки для ванн и туалетов.
5) Углекислый газ выделяется при реакциях горения.
Горение метана.
CH4 + 2O2 → CO2 + 2H2O + 891кДж
Метан + кислород = углекислота + вода (в газообразном состоянии) + энергия
Горение этилена
C2H4 + 3O2 → 2CO2 + 2H2O + Q
Этилен + кислород = диоксид углерода + оксид водорода + энергия
Горение этана
2С2Н6 + 7О2 → 4CO2 + 6H2O + Q
Этан + кислород = двуокись углерода + вода + энергия
Горение этанола
C2H5OH + 3O2 = 3H2O + 2CO2 + Q
Этанол + кислород = вода + углекислота + энергия
6) Газ не поддерживает горения, этот процесс возможен только с некоторыми активными металлами, например, магнием.
2Mg + CO2 = C + 2MgO
Магний + углекислота = углерод + оксид магния.
MgO активно применяется при производстве косметических средств. Вещество используют в пищевой промышленности как пищевую добавку.
7) Двуокись углерода реагирует с гидроксидами с получением солей, которые существуют в двух формах, как карбонаты и бикарбонаты. Например, углекислый газ и гидроксид натрия, согласно формуле, образуют гидрокарбонат Na:
CO2 + NaOH → NaHCO3
диоксид углерода + гидроксид натрия → гидрокарбонат натрия.
Или же при большем количестве NaOH образуется карбонат Na с образованием воды:
CO2 + 2 NaOH → Na2CO3 + H2O
Диоксид углерода + гидроксид натрия → карбонат натрия + вода
Кислотно-щелочные реакции углекислоты используются на протяжении веков для затвердевания известкового раствора, что может быть выражено простым уравнением:
Ca(OH)2 + CO2 → CaCO3 + H2O
Гидроксид кальция + двуокись углерода → карбонат кальция + оксид водорода
В зелёных растениях играет важную роль в процессе фотосинтеза:
6CO2 + 6H2O → C6H12O6 + 6O2
Диоксид углерода + вода → глюкоза + кислород.
9) Химические свойства углекислоты используются в промышленности при производстве соды, суть этого процесса можно выразить суммарным уравнением:
NaCl + CO2 + NH3 + H2O → NaHCO3 + NH4Cl
Хлорид натрия + Диоксид углерода + аммиак + вода → гидрокарбонат натрия + хлорид аммония
10) Фенолят Na разлагается при взаимодействии с углекислым газом, при этом малорастворимый фенол выпадает в осадок:
C6H5ONa + CO2 + H2O = C6H5OH + NaHCO3
Фенолят натрия + двуокись углерода + оксид водорода = фенол + гидрокарбонат натрия
11) Пероксид натрия и углекислый газ, взаимодействуя, образуют среднюю соль карбоната Na с выделением кислорода.
2Na2O2 + 2CO2 → 2N2CO3 + O2
Пероксид натрия + углекислота → карбонат натрия + кислород
Колба с пероксидом натрия
Образование углекислоты происходит при растворении в воде кальцинированной соды (стиральной соды).
NaHCO3 + H2O → CO2 + H2O + NaOH
Гидрокарбонат натрия + вода → углекислота + вода + гидроксид натрия При этой реакции (гидролиз по катиону) образуется сильнощелочная среда.
12) CO2 вступает в реакцию с гидроксидом калия, последний образуется путем электролиза хлористого калия.
2KOH + CO2 → K2CO3 + H2O
Гидроксид калия + углекислота → карбонат калия + вода
13) Газ в силу своего строения не реагирует с благородными газами, то есть гелием, неоном, аргоном, криптоном, ксеноном, радоном, оганесоном.
Углекислый газ, формула, молекула, строение, состав, вещество:
Углекислый газ (диоксид углерода, двуокись углерода, углекислота, оксид углерода (IV), угольный ангидрид) – бесцветный газ, почти без запаха (в больших концентрациях с кисловатым «содовым» запахом).
Углекислый газ – бинарное химическое соединение углерода и кислорода, имеющее формулу CO2.
Химическая формула углекислого газа CO2.
Строение молекулы углекислого газа, структурная формула углекислого газа:
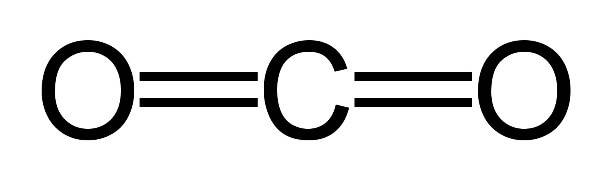
Углекислый газ тяжелее воздуха приблизительно в 1,5 раза. Его плотность при нормальных условиях составляет 1,98 кг/м3, по отношении к воздуху – 1,524. Поэтому скапливается в низких непроветриваемых местах.
Концентрация углекислого газа в воздухе (в атмосфере Земли) составляет в среднем 0,046 % (по массе) и 0,0314 % (по объему).
Углекислый газ вырабатывается в органах и тканях человека образуется в качестве одного из конечных продуктов метаболизма. Он переносится от тканей по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, уменьшается в капиллярной сети лёгких, и содержание его мало в артериальной крови. В выдыхаемом человеком воздухе содержится около 4,5% диоксида углерода, что в 60-110 раз больше, чем во вдыхаемом. Организм человека выделяет приблизительно 1 кг углекислого газа в сутки.
Углекислый газ растворяется в воде. В 100 граммах воды растворяется 0,3803 грамма CO2 при 16 °C, 0,3369 грамма CO2 – при 20 °C, 0,2515 грамма CO2 – при 30 °C. Растворяясь в воде, образует угольную кислоту Н2CO3. Растворим также в ацетоне, бензоле, метаноле и этаноле.
Термически устойчив при температурах менее 1000 °C. При температуре 1000 °C восстанавливается углем до оксида углерода (II).
При нормальном атмосферном давлении диоксид углерода не существует в жидком состоянии, существует только в твердом или газообразном состоянии. Твердая двуокись углерода при повышении температуры не плавится, а переходит (возгоняется) непосредственно из твёрдого состояния в газообразное. Твёрдую двуокись углерода также называют сухим льдом. Внешний вид сухого льда напоминает обычный лед, снегоподобную массу. При сублимации сухой лед поглощает около 590 кДж/кг (140 ккал/кг) теплоты.
Под давлением 35 000 атм. твердая углекислота становится проводником электрического тока.
Жидкий углекислый газ можно получить при повышении давления. Так, при температуре 20 °С и давлении свыше 6 МПа (~60 атм.) газ сгущается в бесцветную жидкость. При нормальных условиях (20 °С и 101,3 кПа) при испарении 1 кг жидкой углекислоты образуется 509 л углекислого газа. Хранят и транспортируют углекислый газ, как правило, в жидком состоянии
Двуокись углерода негорюча, но в ее атмосфере может поддерживаться горение активных металлов, например, щелочных металлов и щелочноземельных – магния, кальция, бария.
Двуокись углерода нетоксична, невзрывоопасна.
Предельно допустимая концентрация двуокиси углерода в воздухе рабочей зоны не установлена, при оценке этой концентрации можно ориентироваться на нормативы для угольных и озокеритовых шахт, установленные в пределах 0,5% (об.) или 9,2 г/м (см. ГОСТ 8050-85 «Двуокись углерода газообразная и жидкая. Технические условия»).
По степени воздействия на организм человека двуокись углерода относится к 4-му классу опасности по ГОСТ 12.1.007-76.
При концентрациях более 5% (92 г/м) двуокись углерода оказывает вредное влияние на здоровье человека, так как она тяжелее воздуха в полтора раза и может накапливаться в слабопроветриваемых помещениях у пола и в приямках, а также во внутренних объемах оборудования для получения, хранения и транспортирования газообразной, жидкой и твердой двуокиси углерода. При этом снижается объемная доля кислорода в воздухе, что может вызвать явление кислородной недостаточности и удушья.
Углекислый газ образуется при гниении и горении органических веществ, в результате вулканической деятельности. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Искусственными источниками образования углекислого газа являются промышленные выбросы и выхлопные газы автомобильного транспорта.
Углекислый газ легко пропускает излучение в ультрафиолетовой и видимой частях спектра, которое поступает на Землю от Солнца и обогревает её. В то же время он поглощает испускаемое Землёй инфракрасное излучение и является одним из парниковых газов, вследствие чего участвует в процессе глобального потепления.
Применение
В пищевой промышленности углекислота используется как консервант и разрыхлитель, обозначается на упаковке кодом Е290.
В криохирургии используется как одно из основных веществ для криоабляции новообразований.
Жидкая углекислота широко применяется в системах пожаротушения и в огнетушителях. Автоматические углекислотные установки для пожаротушения различаются по системам пуска, которые бывают пневматическими, механическими или электрическими.
Устройство для подачи углекислого газа в аквариум может включать в себя резервуар с газом. Простейший и наиболее распространенный метод получения углекислого газа основан на конструкции для изготовления алкогольного напитка браги. При брожении, выделяемый углекислый газ вполне может обеспечить подкормку аквариумных растений
Углекислый газ используется для газирования лимонада и газированной воды. Углекислый газ используется также в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его распад с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в инертной среде.
Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании.
Хранение углекислоты в стальном баллоне в сжиженном состоянии выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру +31 °С. В стандартный 40-литровый баллон заливают около 30 кг сжиженного углекислого газа, и при комнатной температуре в баллоне будет находиться жидкая фаза, а давление составит примерно 6 МПа (60 кгс/см²). Если температура будет выше +31 °С, то углекислота перейдёт в сверхкритическое состояние с давлением выше 7,36 МПа. Стандартное рабочее давление для обычного 40-литрового баллона составляет 15 МПа (150 кгс/см²), однако он должен безопасно выдерживать давление в 1,5 раза выше, то есть 22,5 МПа, — таким образом, работа с подобными баллонами может считаться вполне безопасной.
Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле, при ремонте оборудования (например: охлаждение одной из сопрягаемых деталей при посадке внатяг) и т. д. Для сжижения углекислого газа и получения сухого льда применяются углекислотные установки.
Применение
По ряду оценок, потребление СО2 на мировом рынке превышает 20 млн. метрических тонн в год. Столь высокий уровень потребления формируется под влиянием требований пищевой промышленности и нефтепромысловых предприятий, технологий газирования напитков и других промышленных нужд, например, снижения показателя Ph установок водоочистки, проблем металлургии (в том числе использования сварочного газа) и т.д.
Потребление углекислого газа неуклонно растет, поскольку расширяются сферы его применения, которые охватывают задачи от промышленного назначения до пищевого производства – консервация продуктов, в машиностроении от сварочного производства и приготовления защитных сварочных смесей до очистки поверхностей деталей гранулами «сухого льда», в сельском хозяйстве для подкормки растений, в газовой и нефтяной промышленности при пожаротушении.