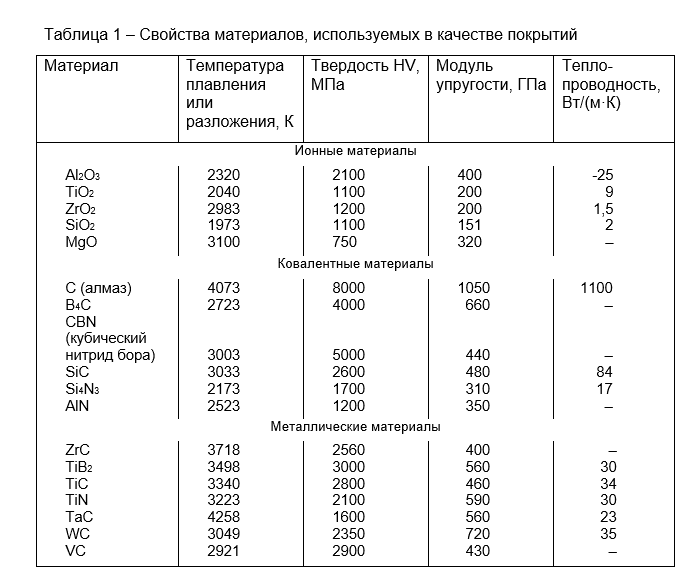
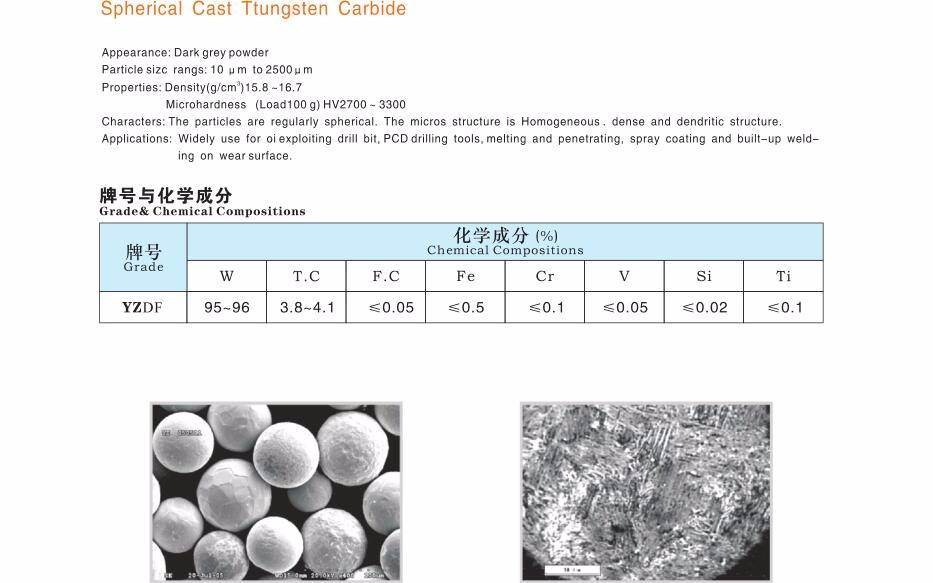
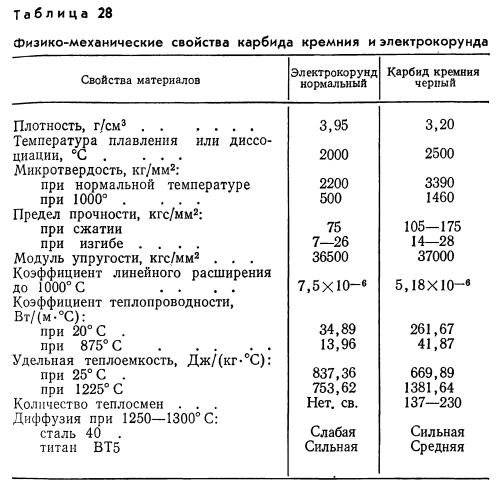
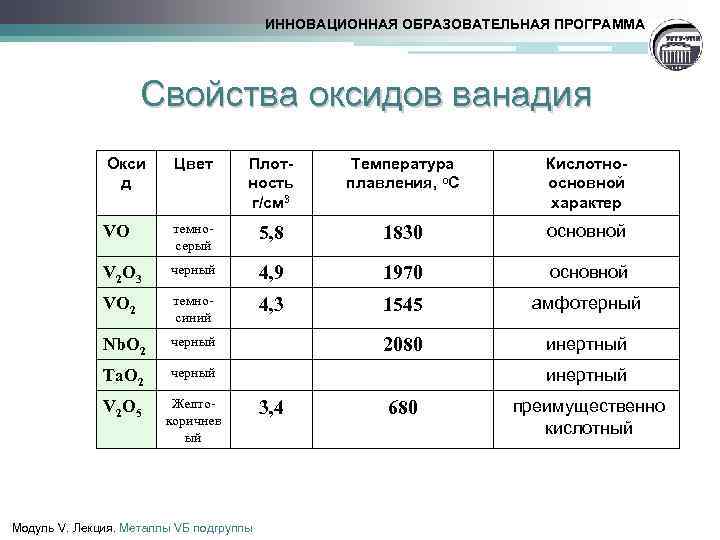
Структура [ править ]
Структура α-WC, атомы углерода серые.
Существуют две формы WC: гексагональная форма α-WC ( hP2 , пространственная группа P 6 м2, № 187) и кубическая высокотемпературная форма β-WC, имеющая породу солевой состав . Гексагональную форму можно представить себе как состоящую из простой гексагональной решетки атомов металла слоев, лежащих непосредственно друг над другом (т. Е. Не плотно упакованных), с атомами углерода, заполняющими половину пустот, придающими как вольфраму, так и углероду правильную тригонально-призматическую форму. , 6 согласований . Из размеров элементарной ячейки можно определить следующие длины связей: расстояние между атомами вольфрама в гексагонально упакованном слое составляет 291 мкм, кратчайшее расстояние между атомами вольфрама в прилегающих слоях составляет 284 мкм, а длина углеродной связи вольфрама составляет 220 мкм. Таким образом, длина связи вольфрам-углерод сравнима с одинарной связью в W ( CH3)6(218 пм), в котором сильно искажена тригонально-призматическая координация вольфрама.
Молекулярный WC был исследован, и эта газовая фаза имеет длину связи 171 пм для 184W12C .
Область применения
Из-за своих уникальных свойств вольфрам получил широкое применение. В промышленности он применяется в чистом виде и в сплавах.
Основными областями применения являются:
Стали специальные. При производстве быстрорежущих сталей и для инструментальных сталей этот материал применяется в качестве легирующего элемента или же основного компонента. Из таких сталей производят штампы, пуансоны, фрезы, свёрла и прочие. Буква «Р» в названии сплава означает, что это быстрорежущая сталь, а буквы «К» или «М» — сталь легированная кобальтом или молибденом. Вольфрам ещё входит в состав сталей магнитных, которые подразделяются на вольфрам кобальтовые и вольфрамовые.
Сплавы твёрдые на основе карбида вольфрама. Это соединение углерода и вольфрама. Он тугоплавкий, износостойкий и имеет высокую твёрдость. Из него изготавливают рабочие части буровых и режущих инструментов.
Износостойкие и жаропрочные сплавы. В них использована тугоплавкость вольфрама. Наиболее распространёнными являются хромовые и кобальтовые соединения — стеллиты. Обычно их при помощи наплавки наносят на сильно изнашивающиеся машинные детали.
Тяжёлые и контактные соединения. К ним относят сплавы вольфрама с серебром и медью. Это довольно эффективные контактные материалы для производства рабочих частей выключателей, рубильников, электродов для точечной сварки и прочих оборудований.
Электроосветительная и электровакуумная техника. Вольфрам в виде разных кованых деталей, ленты или проволоки используют в производстве рентгенотехники, радиоэлектроники и электроламп. Это лучший материал для спиралей и нитей накаливания. Вольфрамовые прутки и проволоки служат для высокотемпературных печей электронагревателями. Эти электронагреватели могут работать в атмосфере инертного газа, водорода или вакуума.
Сварочные электроды
Сварка является важной сферой для применения этого металла. Из него делают электроды для сварки дуговой, так как они неплавкие.
https://youtube.com/watch?v=jmjsaMmSNwo
Вольфрам — самый тугоплавкий металл
Вольфрам — простое химическое вещество, элемент таблицы Менделеева, переходный металл. Записывается в виде латинской буквы W. Название получил от минерала вольфрамит, известного рудокопам с 16-го века. Сам минерал Wolf Rahm (в переводе с немецкого — «волчья пена») получил свое название из-за того, что осложнял получение олова из оловосодержащих пород. При выплавке примеси вольфрама образовывали соединения с оловом и поднимались на поверхность в виде пены; на языке рудокопов «пожирают олово как волк овцу».
Относится к редким элементам, по распространенности на планете занимает 57-е место. Встречается только в минералах, состоящих из соединений разных металлов. В добывающей индустрии наиболее значимы вольфрамит, шеелит, фербелит, гюбнерит. В месторождениях концентрация вольфрама редко превышает 2%.
Как отдельный химический элемент вольфрам был открыт в конце XVIII века. Известный шведский химик К. Шееле проводил эксперименты с минералом тунгстен (позже переименованным в его честь и названным шеелитом). Обработав его азотной кислотой, ученый выяснил, что образец представляет собой соль неизвестной кислоты. Его ученики продолжили работы с интересным минералом и через два года настойчивых исследований выделили неизвестный науке металл, который назвали вольфрамом. Большого шума это открытие не вызвало, т.к. новый металл был чрезвычайно тугоплавким и в мире просто еще не существовало печей, способных обеспечить необходимую температуру для выплавки. Зато в ХХ веке вольфрам произвел в промышленности настоящую революцию.
|
|
| Электропечи с максимальной температурой нагрева +1300 °С | Электропечи с максимальной температурой нагрева +1100 °С |
Свойства
Светло-серебристый блестящий металл, напоминающий платину. Очень плотный, тяжелый, твердый, но, при этом, хрупкий. Плавится при t около +3400 °C, это самый высокий показатель среди металлов. (Теоретически более тугоплавким может быть трансактиноид сиборгий, но это короткоживущий радиоактивный элемент №106, получаемый искусственно в результате ядерного синтеза.) В нормальных условиях вольфрам плохо поддается механической обработке, зато при нагреве свыше +1600 °С его можно ковать, прокатывать, вытягивать в тонкую нить. Парамагнетик (может намагничиваться во внешнем магнитном поле), обладает высоким электрическим сопротивлением.
В химических реакциях может проявлять валентность от 2 до 6, но все устойчивые соединения образованы W (VI). При температуре в районе +20 °С не поддается коррозии в воде и на воздухе. Очень слабо реагирует с соляной, фтороводородной и неконцентрированной серной кислотами. А вот с перекисью водорода, азотной кислотой, смесью азотной и фтороводородной кислот, «царской водкой» взаимодействует легко. При высокой t и в присутствии окислителей вступает в реакции со щелочами. Образует оксиды, вольфраматы (соли вольфрамовых кислот), соединения с галогенами, серой, углеродом.
В метаболизме животных и человека не участвует.
Вольфрамовая пыль, как и пыль любого другого металла, оказывает раздражающее влияние на органы дыхания.
Это интересно
На Земле существует несколько типов архебактерий и бактерий, использующих в своих обменных процессах ферменты с вольфрамом. Ученые считают, что они ведут свое развитие с ранней архейской эры (около 4 млрд. лет назад), когда этот металл играл важную роль в создании и развитии жизни на планете.
Вольфрам — крайне востребованный в промышленности металл. Подробнее о его применении мы расскажем в следующей статье.
Основные характеристики вольфрама:
- Порядковый номер74
- Атомный вес183,82
- Плотность19,3
- Радиус атома1,41
- Радиус шестивалентного иона0,50
- Электросопротивление5,5*20
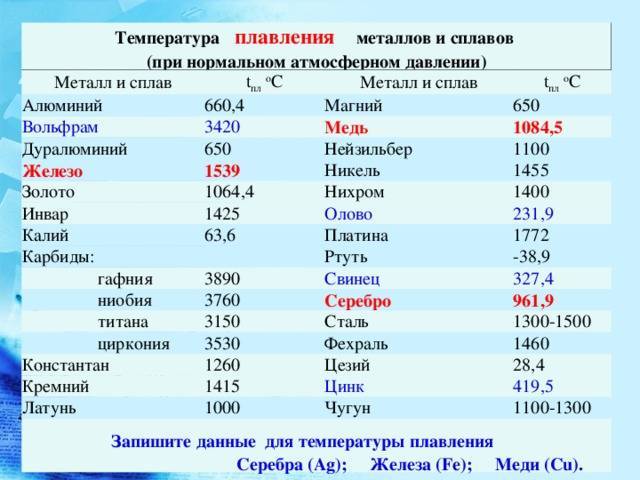
- Температура плавления3377
Удельное электросопротивление 5,5 ом·см (20 °C). На воздухе вольфрам не изменяется, однако в присутствии влаги порошкообразный вольфрам медленно окисляется; при 700 °C вольфрам разлагает воду с образованием двуокиси вольфрама и водорода. Кислоты на вольфрам почти не действуют. Концентрированная азотная кислота и царская водка окисляют вольфрам с поверхности; растворяется же он в смеси фтористоводородной и азотной кислот.
Растворение металлического вольфрама возможно также в насыщенном растворе щавелевой кислоты в присутствии пергидроля, при этом образуются комплексные соединения вольфрама с щавелевой кислотой.
Температура кипения вольфрама около 5800°K. Упругость паров вольфрама изменяется с температурой следующим образом:
| Температура °C | 3990 | 4507 | 4690 | 4886 | 5168 | 5403 |
| Упругость пара, мм рт.ст | 1 | 10 | 20 | 60 | 100 | 200 |
Растворы щелочей не действуют на вольфрам, однако в присутствии окислителей, например перекиси водорода или персульфата аммония, вольфрам может растворяться в аммиаке. В присутствии же окислителей металлический вольфрам хорошо сплавляется со щелочами или с содой, образуя, так же как и в предыдущем случае, соль вольфрамовой кислоты.
Трехокись вольфрама или вольфрамовый ангидрид. Важнейшее соединение, являющееся конечным продуктом переработки вольфрамового сырья,-желтое порошкообразное вещество, при нагревании оранжевое. Упругость паров трехокиси вольфрама достигает одной атмосферы при 1357°C, но заметная вагонка начинается при значительно более низких температурах. Поэтому при получении трехокиси вольфрама прокаливанием вольфрамовой кислоты не рекомендуется, во избежание потерь, повышать температуру печи выше 800-850°C.Если же требуется прокалить вольфрамовую кислоту с целью количественного определения вольфрама, то придерживаются еще более низких температур – 750-800°C.
Трехокись вольфрама практически нерастворима в воде и в кислотах.
Сплав – карбид – вольфрам
Сплав карбида вольфрама с 16 % кобальта настолько тверд, что может частично заменить алмаз при бурении скважин.
В сплавах карбида вольфрама с молибденом может быть 90 и более процентов твердой фазы. Между частицами карбида вольфрама существуют контакты, хорошо различимые в микроскопе. А в дисперсионно-упрочненных сплавах содержание твердой фазы составляет не более 20 процентов. Твердые частицы упрочняющей фазы изолированы, здесь металлической фазой. Композиция карбида вольфрама с – кобальтом как исключение причислена к классу диспер-сионно-упрочнен ных сплавов. Над загадкой счастливого брака карбида вольфрама и кобальта и технологией получения твердых сплавов на их основе продолжают работать научные коллективы многих стран.
Стеллиты представляют собой сплавы карбидов вольфрама и хрома, связанные кобальтом и железом. Присутствие вольфрама и кобальта удорожает эти сплавы и поэтому они применяются значительно реже сормайта.
Чем больше в сплаве карбида вольфрама, тем сплав тверже, но тем более он хрупок. Вязкость сплава, дающая возможность воспринимать ударные нагрузки, обеспечивается кобальтом. Сплав ВК2, содержащий всего 2 % кобальта, обладает весьма низкой вязкостью.
Чем больше в сплаве карбида вольфрама ( сплавы ВК), тем более он хрупок и менее прочен.
Металлокерамические твердые сплавы представляют собой сплавы карбидов вольфрама и карбидов титана с кобальтом и приготовляются путем прессования и спекания. Эти сплавы применяются для скоростной обработки металлов резанием в виде пластинок, напаиваемых на державку езца. Металлокерамические твердые стали разделяются по ГОСТ 3882 – 53 на две группы.
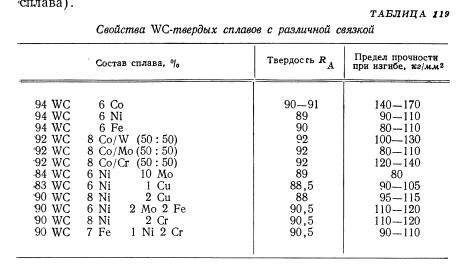
В табл. 51 приведены некоторые свойства покрытий из сплавов карбида вольфрама.
К первой группе относятся вольфрамовые однокар-бидные сплавы типа ВК ( ВК2, ВКЗМ, ВК4, ВК6, ВК6М, ВК8, ВК8В), представляющие сплав карбида вольфрама с кобальтом, содержание которого колеблется в пределах от 2 до 8 % и выше.
Наиболее подробно изученными являются сплавы монокарбида вольфрама с кубическими карбидами, среди которых особое внимание уделяется сложным карбидам TiC-WC, нашедшим широкое практическое использование в составе металлокерамических твердых сплавов. Показано, что сплавы карбида вольфрама с кубическими карбидами обладают оптимальными свойствами в области твердых растворов
При этом четко проявляется общая тенденция понижения растворимости карбида вольфрама в кубических карбидах при переходе от металлов IV к металлам V группы. Так как в карбиде вольфрама прочность связи Me-С низкая ( из-за незначительной стабилизации 5 / з3 – конфигураций атомов углерода) и WC обладает высоким запасом свободной энергии, то указанный характер изменения растворимости WC в кубических карбидах указывает на различную степень их взаимодействия с карбидом вольфрама, определяемую донорными свойствами металлов карбидов-растворителей.
Еще шире, чем в чистом виде, вольфрам применяется в форме сплавов. Одни из самых важных – металлокврамические сплавы карбида вольфрама и кобальта, которые получили исключительно большое значение, так как Обладают чрезвычайно высокой твердостью.
Вольфрам образует карбиды WC и W2C – вещества, по твердости близкие к алмазу; их применяют в производстве твердых материалов. Большое значение, в частности для буровой техники, имеют сплавы карбида вольфрама с кобальтом, обладающие чрезвычайно большой твердостью. Такой сверхтвердый сплав, называемый победитом, содержит около 90 % карбида вольфрама и около 10 % кобальта.
| Типы ( модели и технические характеристики двухшнековых машин. |
Оба шнековых вала выполнены из нитрированной стали. При желании для переработки абразивных материалов они могут быть полностью или частично покрыты сплавом карбидов вольфрама. Корпус машины охватывает зоны загрузки, смешения и участок дросселирующего элемента. К нему на фланцах присоединен корпус с двумя цилиндрами для разгрузочных шнеков. Корпус этих шнеков изготовлен также из нитрированной стали. Он укреплен на станине машины откидными болтами и при чистке машины может отводиться на роликах.
Металлический – кобальт, серовато-стального цвета, по внешнему виду сходен с железом, но тверже его и никеля. В тонко раздробленном состоянии он легко окисляется во влажном воздухе. При температуре белого каления он сгорает в СозО – i. Из сплавов кобальта назовем стеллит, сталь, содержащую кобальт и хром, отличающуюся весьма большой твердостью и противокоррозийными свойствами; карбалой, сплав карбида вольфрама с кобальтом, также отличается своей очень большой твердостью; магнитную сталь, содержащую 35 % кобальта. Окись кобальта служит для окраски стекла и эмали в синий цвет.
Свойства
Рассматриваемое вещество представлено серым порошком в двух кристаллографических вариантах: с кубической (полукарбид) и гексагональной (монокарбид) решетками. Обе модификации встречаются в температурном диапазоне 2525 — 2755°С. Вторая фаза ввиду отсутствия области гомогенности при отклонении от стехиометрического состава образует графит или переходит в W2C, а при температуре более 2755°С разлагается до углерода и первой фазы. Последняя отличается обширной областью гомогенности, сокращающейся при снижении температуры.
Монокарбид вольфрама менее тверд в сравнении с полукарбидом, но способен формировать кристаллы. Второй вариант значительно более температуро- и износоустойчив. К тому же он способен к внедрению в твердые растворы.
Карбид вольфрама отличается хрупкостью, но под влиянием нагрузки проявляет пластичность полосами скольжения.
Кристаллы рассматриваемого вещества характеризуются анизотропией твердости от 13 до 22 ГПа на разных кристаллографических плоскостях.
Монокарбид имеет температуру плавления 2870°C, кипения — 6000°C. Его молярная теплоемкость равна 35,74 Дж/(моль-*К), теплопроводность — 29,33 кДж/моль. Плотность карбида вольфрама данного типа составляет 15,77 г/см3.
Несмотря на то, что температура плавления большая, термостойкость рассматриваемого материала низка. Это обусловлено отсутствием термического расширения ввиду жесткой структуры. При этом карбид вольфрама характеризуется высокой теплопроводностью. С повышением температуры данный параметр у монокарбида возрастает вдвое быстрее, чем у полукарбида.

Кольцо из карбида вольфрама
Рассматриваемые материалы имеют хорошую электропроводность, особенно полукарбид (в 4 раза выше, чем монокарбид). Удельное электросопротивление возрастает с повышением температуры, но при этом снижается упругость. Это обуславливает обрабатываемость электрофизическими методами. Так, при введении источника тепла в области обработки возрастает температура, способствуя размеренному разрушению структуры материала.
Твердость определяется температурой формирования карбидов в вольфрамовом порошке и (в меньшей степени) их пористостью. С ростом температуры увеличивается подвижность атомов составляющих соединения элементов, вследствие чего устраняются дефекты в зернах. Анизотропия параметров карбидов вольфрама меньше, чем для металлов. К тому же данные материалы отличаются наилучшей для тугоплавких металлов упругостью, которая увеличивается с ростом пористости. Однако пластичность низкая (до 0,015%).

Микроструктура карбида вольфрама
Карбид вольфрама характеризуется стойкостью к многим кислотам, а также их смесям при обычной температуре, но растворим в некоторых кислотах при кипении. Не подвержен растворению в 20% и 10% гидроксиде натрия. Ввиду высокой летучести оксида вольфрама начинает окисляться при 500 — 700°C и завершает окисление при более 800°C.
Наконец, ввиду химической инертности данное соединение нетоксично.
Применение вольфрама в промышленности
Вольфрам начали активно применять в различных сферах промышленности не так уж и давно. На протяжении долгого времени он не мог найти практического применения, но сейчас больше половины всего вольфрама идет на производство вольфрамовых сплавов различной прочности. Перечислим сферы и области применения вольфрама более подробно:
— электротехническая промышленность. Вольфрам незаменим в данной сфере, так как из его изготавливают нити накалывания электрических ламп, катоды рентгеновских трубок и различные детали для радиоламп.
— химическая промышленность. В данной сфере вольфрам применяют в качестве сырья для изготовления пигментов, красок и смазочных материалов. Помимо этого, данный неметаллический элемент применяют как катализатор.
— военная промышленность. Вольфрам был одним из основных сырьевых материалов в данной сфере во времена Первой Мировой войны. Его применяют для производства пуль, орудийной стали и бронебойных снарядов.
— автомобильная промышленность. Вольфрам выступает в качестве легированного элемента некоторых видов стали. Он придает стали уникальных свойств и позволяет использовать её для производства автомобильных прочных рессор. Более подробно об этом можно узнать в нашей статье «Сферы и области применения стали».
— железнодорожная промышленность. Вольфрамовая сталь применяется для производства железнодорожных рельс и вагонов. Такие рельсы могут выдержать очень большие нагрузки. Кроме того, их срок эксплуатации намного больше, чем из других видов стали.
— металлургическая промышленность
Наиболее важное предназначение вольфрама в металлургии – это легирование им сталей, а также производство твердых сплавов
§3. Вольфрамовая проволока
Производство Вольфрамовая проволока — один из самых распространенных видов продукции из данного тугоплавкого металла. Исходным материалом для ее изготовления являются кованые вольфрамовые прутки диаметром 2,75 мм.
Волочение проволоки производится при температуре 1000 °С в начале процесса и 400-600 °С — в конце. При этом нагревается не только проволока, но и фильера. Нагрев осуществляется пламенем газовой горелки или электрическим нагревателем.
Волочение проволоки диаметром до 1,26 мм ведут на прямолинейном цепном волочильном стане, в пределах диаметра 1,25-0,5 мм — на блочном стане с диаметром катушки ~1000 мм, диаметра 0,5-0,25 — на машинах однократного волочения.
В результате ковки и волочения структура заготовки превращается в волокнистую, которая состоит из осколков кристаллов, вытянутых вдоль оси обработки. Такая структура приводит к резкому повышению прочности проволоки из вольфрама.
После волочения вольфрамовая проволока покрыта графитовой смазкой. Поверхность проволоки необходимо очистить. Очистку производят с помощью отжига, химического или электролитического травления, электролитической полировки. Полировка может увеличить механическую прочность вольфрамовой проволоки на 20-25%.
Применение
Вольфрамовая проволока используется для изготовления элементов сопротивления в нагревательных печах, работающих в атмосфере водорода, нейтрального газа или в вакууме при температурах до 3000 °С. Также проволока из вольфрама служит для производства термопар. Для этого используются вольфрам-рениевый сплав с 5% рения и вольфрам-рениевый сплав с 20% рения (ВР 5/20). В ГОСТ 18903-73 “Проволока вольфрамовая. Сортамент” указаны области применения проволоки марок ВА, ВМ, ВРН, ВТ-7, ВТ-10, ВТ-15. Вольфрамовая проволока ВА в зависимости от группы, состояния поверхности и металла, диаметра применяется для изготовления спиралей ламп накаливания и других источников света, спиралеобразных катодов и подогревателей электронных приборов, пружин полупроводниковых приборов, петлевых подогревателей, неспиралеобразных катодов, сеток, пружин электронных приборов. Проволока марки ВРН применяется при получении вводов, траверсов и других деталей приборов, не требующих применения вольфрама со специальными присадками.
Получение вольфрама: порошок и компактный металл
Вольфрам, как многие другие элементы редкой группы, не встречается в природе. Поэтому добыча металла не сопровождается строительством крупных промышленных комплексов. Сам процесс получения материала условно делят на такие этапы:
- Добыча руды, содержащей редкий металл.
- Создание условий для возможного выделения вольфрама от перерабатываемой массы.
- Концентрирование материала в виде раствора или осадка.
- Очищение полученного химического соединения.
- Получение чистого вещества.

Вольфрамовая руда
Более сложным оказывается процесс изготовления компактного металла, к примеру, вольфрамовой проволоки. Основная трудность заключается в том, что нельзя допустить даже малейшего попадания примесей, резко ухудшающих плавкие и прочностные свойства.
Переработка вольфрамового сырья.
Первичная руда содержит около 0,5% оксида вольфрама. После флотации и отделения немагнитных компонентов остается порода, содержащая порядка 70% WO3. Затем обогащенная руда (и окисленный лом вольфрама) выщелачивается с помощью карбоната или гидроксида натрия:
4FeWO4 + O2 + 4Na2CO3 = 4NaWO4 + 2Fe2O3 + 4CO2
6MnWO4 + O2 + 6Na2CO3 = 6Na2WO4 + 2Mn3O4 + 6CO2
WO3 + Na2CO3 = Na2WO4 + CO2
WO3 + 2NaOH = Na2WO4 + H2O
Na2WO4 + CaCl2 = 2NaCl + CaWO4Ї.
Полученный раствор освобождается от механических примесей, а затем подвергается переработке. Первоначально осаждается вольфрамат кальция с последующим его разложением соляной кислотой и растворением образовавшегося WO3 в водном аммиаке. Иногда очистку первичного вольфрамата натрия осуществляют с помощью ионообменных смол. Конечный продукт процесса – паравольфрамат аммония:
CaWO4 + 2HCl = H2WO4Ї + CaCl2
H2WO4 = WO3 + H2O
WO3 + 2NH3·H2O(конц.) = (NH4)2WO4 + H2O
12(NH4)2WO4 + 14HCl(оч.разб.) = (NH4)10H2W12O42 + 14NH4Cl + 6H2O
Другим способом выделения вольфрама из обогащенной руды является обработка хлором или хлороводородом. Этот метод основан на относительно низкой температуре кипения хлоридов и оксохлоридов вольфрама (300° С). Способ применяется для получения особо чистого вольфрама.
Вольфрамитовый концентрат может быть сплавлен непосредственно с углем или коксом в камере с электрической дугой. При этом получают ферровольфрам, который используется при изготовлении сплавов в сталелитейной промышленности. Чистый концентрат шеелита также может быть добавлен в расплав стали.
Около 30% мирового потребления вольфрама обеспечивается за счет переработки вторичного сырья. Загрязненный лом карбида вольфрама, стружки, опилки и остатки порошкового вольфрама окисляются и переводятся в паравольфрамат аммония. Лом быстрорежущих сталей утилизируют в производстве этих же сталей (до 60–70% всего расплава). Лом вольфрама из ламп накаливания, электродов и химических реактивов практически не перерабатывается.
Основным промежуточным продуктом в производстве вольфрама является паравольфрамат аммония (NH4)10W12O41·5H2O. Он является и основным транспортируемым соединением вольфрама. Прокаливая паравольфрамат аммония, получают оксид вольфрама(VI), который затем обрабатывают водородом при 700–1000° С и получают порошок металлического вольфрама. Спеканием его с углеродным порошком при 900–2200° С (процесс цементации) получают карбид вольфрама.
В 2002 цена паравольфрамата аммония – основного коммерческого соединения вольфрама – составляла около 9000 долл. за тонну в пересчете на металл. В последнее время появилась тенденция к снижению цен на вольфрамовую продукцию вследствие большого предложения со стороны Китая и стран бывшего СССР.
В России вольфрамовые продукты производят: Скопинский гидрометаллургический завод «Металлург» (Рязанская область, вольфрамовый концентрат и ангидрид), Владикавказский Завод «Победит» (Северная Осетия, вольфрамовый порошок и слитки), Нальчикский Гидрометаллургический завод (Кабардино-Балкария, металлический вольфрам, карбид вольфрама), Кировградский завод твердых сплавов (Свердловская область, карбид вольфрама, вольфрамовый порошок), Электросталь (Московская область, паравольфрамат аммония, карбид вольфрама), Челябинский Электрометаллургический завод (ферровольфрам).